题目内容
溴水在科学实验中具有重要的作用,如可用于物质的鉴别和分离提纯.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,请列式计算原混合气体中乙烯和甲烷的物质的量之比是多少?
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:乙烯和甲烷的混合气通入足量的溴水中,只有乙烯能与溴水反应,充分反应后,溴水的质量增加1.4g为乙烯的质量,利用n=
计算其物质的量,利用n=
来计算混合气体的总物质的量,进而计算原气体混合物中甲烷的物质的量,据此解答.
| m |
| M |
| V |
| Vm |
解答:
解:乙烯的物质的量为:n(C2H4)=1.4g÷28g?mol-1=0.05mol,
混合气的总物质的量为:n(混合)=6.72L÷22.4L?mol-1=0.3mol,
n(CH4)=0.3mol-0.05 mol=0.25 mol,
n(C2H4):n(CH4)=0.05:0.25=1:5,
答:原混合气体中乙烯和甲烷的物质的量之比为1:5.
混合气的总物质的量为:n(混合)=6.72L÷22.4L?mol-1=0.3mol,
n(CH4)=0.3mol-0.05 mol=0.25 mol,
n(C2H4):n(CH4)=0.05:0.25=1:5,
答:原混合气体中乙烯和甲烷的物质的量之比为1:5.
点评:本题考查混合物的计算,题目难度不大,注意乙烯与甲烷的性质的差异性,明确溴水增加的质量即为乙烯的质量是解答本题的关键.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
某高分子化合物是制造彩电荧光屏的原料之一,其结构简式为: ,下列有关该高分子化合物的说法不正确的是( )
,下列有关该高分子化合物的说法不正确的是( )
 ,下列有关该高分子化合物的说法不正确的是( )
,下列有关该高分子化合物的说法不正确的是( )| A、不易溶于水 |
| B、可以发生酯化反应 |
| C、可以发生加成反应 |
| D、水解后能得到分子式为C9H8O2的产物 |
能正确表示下列反应的离子方程式是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2═Fe3++2H2O |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
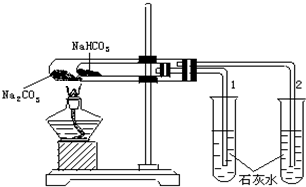 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: