题目内容
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
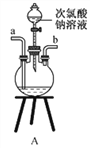
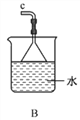
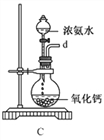

②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是_______________________________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
【答案】 defabc(ef顺序可互换) CaO+NH3·H2O=NH3↑+Ca(OH)2 防止倒吸或安全瓶 防止碘升华 无固体残留且溶液呈无色 2IO-+N2H4=N2↑+2I-+2H2O 趁热过滤 81%
【解析】(1)由反应原理NaClO+2NH3=N2H4·H2O+NaCl可知,要制取水合肼,可以先制备氨气,然后将氨气通入次氯酸钠溶液中进行反应,多余的氨气可以用水吸收,实验中要注意防止倒吸。①用下图装置制取水合肼,其连接顺序为defabc(ef顺序可互换)。
②装置C中发生反应的化学方程式为CaO+NH3·H2O=NH3↑+Ca(OH)2,装置D的作用是防止倒吸(或安全瓶)。
(2)由题意可知,碘和氢氧化钠发生反应3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼发生反应3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,得到氮气与NaI, NaI溶液经蒸发浓缩、冷却结晶可得到NaI。
①步骤一反应温度不宜超过70℃的原因是防止碘升华;该步骤反应完全的现象是无固体残留且溶液呈无色。
②由题意知,步骤二中IO-被N2H4·H2O还原为NaI,该反应的离子方程式为2IO-+N2H4=N2↑+2I-+2H2O。
③步骤三中加入活性炭的目的是对溶液进行脱色,“将溶液与活性炭分离”的方法是趁热过滤。
④8.2gNaOH与25.4g单质碘反应,氢氧化钠过量,碘单质反应完全,碘和氢氧化钠发生反应为3I2+6NaOH=5NaI+NaIO3+3H2O,则生成的NaI的质量为![]() =25g,生成的NaIO3与N2H4H2O反应所得的NaI,反应为3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为
=25g,生成的NaIO3与N2H4H2O反应所得的NaI,反应为3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为![]() =5g,故理论上生成的NaI为25g+5g=30g,所以,本次实验的产率为
=5g,故理论上生成的NaI为25g+5g=30g,所以,本次实验的产率为![]() =81%。
=81%。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案