题目内容
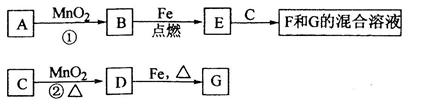
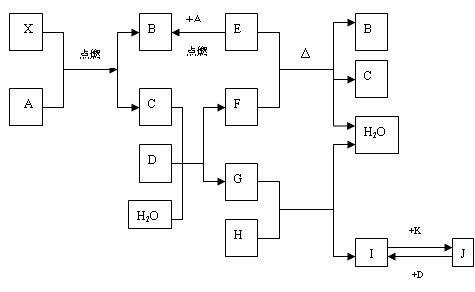
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
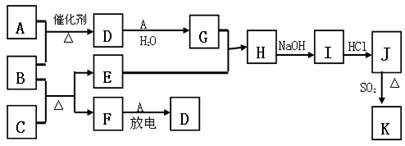
(1)B的电子式为 ;
(2)写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液反应的离子方程式,并用单线桥标出电子转移的方向和数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知: F(g) + A(g) =" 2D" (g) △H =" +180.5KJ/mol"
2C (s)+ O2 (g)= 2CO(g) △H =" -221.0" KJ/mol
C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为: 。

(1)B的电子式为 ;
(2)写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液反应的离子方程式,并用单线桥标出电子转移的方向和数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知: F(g) + A(g) =" 2D" (g) △H =" +180.5KJ/mol"
2C (s)+ O2 (g)= 2CO(g) △H =" -221.0" KJ/mol
C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为: 。
(10分)(每小题各2分)
(1)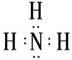
(2)3CuO + 2NH3 3Cu + N2 +3H2O
3Cu + N2 +3H2O
(3)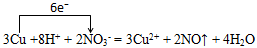
(4)2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)2NO(g)+2CO(g)==N2(g)+2CO2(g) △H= —746.5KJ/mol
(1)
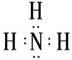
(2)3CuO + 2NH3
 3Cu + N2 +3H2O
3Cu + N2 +3H2O(3)
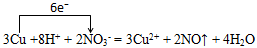
(4)2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)2NO(g)+2CO(g)==N2(g)+2CO2(g) △H= —746.5KJ/mol
E为红色金属单质,即铜;刺激性气体B可与黑色氧化物生成铜与无色气体单质F可联想到反应:3CuO+2NH3 3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2
3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2 2NO;
2NO;
进而可知A与B是氨气的催化氧化:4NH3+5O2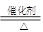 4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
E(铜)与G(硝酸)的稀溶液反应:3Cu +8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
H为硝酸铜,与NaOH生成I:Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2↓;Cu(OH)2+2HCl=CuCl2+2H2O;J即为CuCl2;
CuCl2与SO2反应:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(1)B的电子式为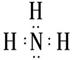
(3)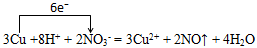
(4)CuCl2被SO2还原得到氯化亚铜沉淀,再根据电子得失、电荷、原子守恒可得离子方程式为:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)①N2(g) + O2(g) =" 2NO" (g) △H = +180.5KJ/mol
②2C (s)+ O2 (g)= 2CO(g) △H =" -221.0" KJ/mol
③C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
根据盖斯定律2×③-①-②可得:2NO(g)+2CO(g)==N2(g)+2CO2(g) △H= —746.5KJ/mol
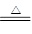 3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2
3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2 2NO;
2NO;进而可知A与B是氨气的催化氧化:4NH3+5O2
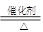 4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;E(铜)与G(硝酸)的稀溶液反应:3Cu +8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
H为硝酸铜,与NaOH生成I:Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2↓;Cu(OH)2+2HCl=CuCl2+2H2O;J即为CuCl2;
CuCl2与SO2反应:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(1)B的电子式为
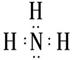
(3)
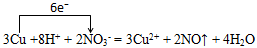
(4)CuCl2被SO2还原得到氯化亚铜沉淀,再根据电子得失、电荷、原子守恒可得离子方程式为:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)①N2(g) + O2(g) =" 2NO" (g) △H = +180.5KJ/mol
②2C (s)+ O2 (g)= 2CO(g) △H =" -221.0" KJ/mol
③C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
根据盖斯定律2×③-①-②可得:2NO(g)+2CO(g)==N2(g)+2CO2(g) △H= —746.5KJ/mol

练习册系列答案
相关题目
 ;
;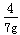
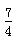 g
g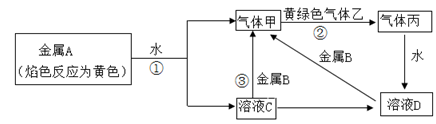
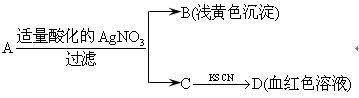
 红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。
红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。