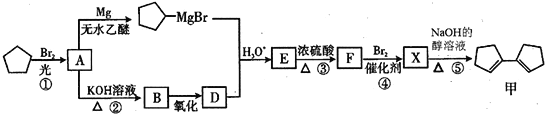
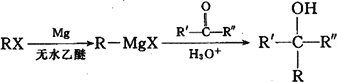题目内容
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
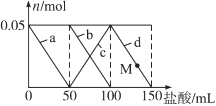
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
【答案】D
【解析】
试题A、a曲线表示Na[Al(OH)4]和盐酸反应生成氢氧化铝和氯化钠的反应,所以发生反应的离子方程式为:[Al(OH)4]-+H+=Al(OH)3↓+H2O,故A正确;B、b曲线表示碳酸钠和盐酸反应,c曲线也表示碳酸钠和盐酸的反应,只是b曲线表示碳酸钠的物质的量,c曲线表示碳酸氢钠的物质的量,所以b和c曲线表示的离子反应是相同的,故B正确;C、因加50mL盐酸之后沉淀不溶解,则M点和50mL时相同,Na[Al(OH)4]中铝元素全部转化为氢氧化铝沉淀,设氢氧化铝的质量为X,
Na[Al(OH)4]+HCl=NaCl+Al(OH)3↓+H2O,
1mol 78g
1molL-1×0.05L XX=3.9g,故C正确;D、由图象知,Na2CO3、Na[Al(OH)4]的物质的量相等都是0.05mol,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与[Al(OH)4]-的物质的量之比,故D错误,故选D。

【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。