��Ŀ����
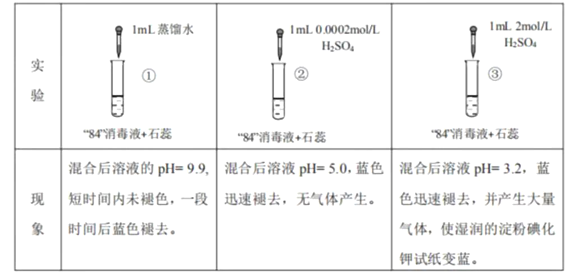
����Ŀ���������Ʊ������������һ����Ҫ���ʡ����������Ĺ̵���Ӧ[��N2(g)+3H2(g)![]() 2NH3(g)�͢�N2(g)+O2(g)
2NH3(g)�͢�N2(g)+O2(g)![]() 2NO(g)]����ƽ�ⳣ������ֵ(lg K)���¶ȵĹ�ϵ����ͼ������ͼ�е������ж�����˵����ȷ����
2NO(g)]����ƽ�ⳣ������ֵ(lg K)���¶ȵĹ�ϵ����ͼ������ͼ�е������ж�����˵����ȷ����
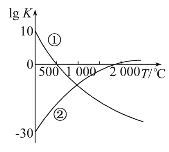
A. ��Ӧ�ٺ͢ھ�Ϊ���ȷ�Ӧ
B. �����¶ȣ���Ӧ�ٵķ�Ӧ���ʼ�С
C. �ڳ����£����÷�Ӧ�ٹ̵������÷�Ӧ�ڹ̵�����Ӧ�̶����ܴ�
D. ��1 000 ��ʱ����Ӧ�ٺͷ�Ӧ����ϵ��N2��Ũ��һ�����
���𰸡�C
��������
A.��������֪�¶�Խ��,ƽ�ⳣ��ԽС,˵�������¶�,ƽ�������ƶ�,��÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��������֪�¶�Խ��,ƽ�ⳣ��Խ��,˵�������¶�,ƽ�������ƶ�,����Ӧ���������ȷ�Ӧ,A������
B.�����¶�,�����Ƿ��ȷ�Ӧ�������ȷ�Ӧ,�����淴Ӧ���ʶ�����,B������
C.�ڳ�����,����ƽ�ⳣ����֪,���÷�Ӧ���̵������÷�Ӧ���̵���Ӧ�̶����ܴ�,C��ȷ��
D.��ͼֻ��֪��1000��ʱ��Ӧ���ͷ�Ӧ����ƽ�ⳣ�����,��ȷ����Ũ�ȵĴ�С,D������
��������������ѡC��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�����Ŀ��һ���¶��£����������ԼΪ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH(g)![]() CH3OCH3(g)��H2O(g)
CH3OCH3(g)��H2O(g)
���� | �¶ȣ����� | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
�� | 387 | 0.40 | ||
�� | 207 | 0.20 | 0.090 | 0.090 |
����˵����ȷ����
A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B���ﵽƽ��ʱ������I�е�CH3OH����������������е�С
C������I�з�Ӧ�ﵽƽ������ʱ����������еij�
D������ʼʱ������I�г���CH3OH 0.1mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������