题目内容
17.综合利用CO2、CO对构建低碳社会有重要意义.(1)Li4SiO4可用于富集得到高浓度CO2.原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生.700℃时反应的化学方程式为Li2CO3+Li2SiO3$\frac{\underline{\;700℃\;}}{\;}$CO2+Li4SiO4.
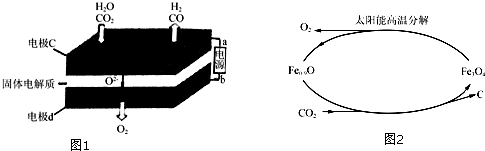
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图1.
①b为电源的正极(填“正极”或“负极”).
②写出电极c发生的电极反应式:CO2+2e-═CO+O2-、H2O+2e-═H2+O2-.
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)?CH3OH(g).对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为50,此时向容器中再通入0.35mol CO气体,则此平衡将向逆反应方向(填“向正反应方向”“不”或“向逆反应方向”)移动.
(4)已知:
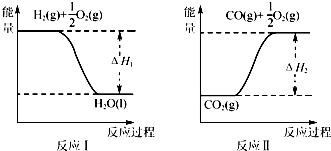
若甲醇的燃烧热为△H3,试用△H1、△H2、△H3表示CO(g)+2H2(g)?CH3OH(l)的△H,则△H=△H=2△H1-△H2-△H3.
(5)利用太阳能和缺铁氧化物可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图2所示,若用1mol缺铁氧化物与足量CO2完全反应可生成0.1mol C(碳).
分析 (1)根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;
(2)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气;
(3)根据平衡常数的计算公式计算,恒温恒压下,体积之比等于物质的量之比,据此计算加入0.35molCO时容器的体积,计算此时浓度商,与平衡常数相比判断反应进行方向;
(4)由图反应Ⅰ可知H2(g)+$\frac{1}{2}$O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+$\frac{1}{2}$O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+$\frac{3}{2}$O2(g)=2H2O(l)+CO2(g),△H3运用盖斯定律计算焓变;
(5)依据反应物和产物利用直平法配平化学方程式,利用碳元素守恒计算得到.
解答 解:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3$\frac{\underline{\;700℃\;}}{\;}$CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3$\frac{\underline{\;700℃\;}}{\;}$CO2+Li4SiO4;
(2)①CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O
+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3)CO(g)+2H2(g)?CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=$\frac{0.2mol/L}{0.4mol/L×(0.1mol/L)^{2}}$=50(mol/L)-2,此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×$\frac{(0.35+0.8+0.2+0.4)mol}{(0.8+0.2+0.4)mol}$=2.5L,则浓度商Qc=$\frac{\frac{0.4}{2.5}}{\frac{1.15}{2.5}×(\frac{0.2}{2.5})^{2}}$=54.3,大于平衡常数50,平衡向逆反应方向移动,
故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+$\frac{1}{2}$O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+$\frac{1}{2}$O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+$\frac{3}{2}$O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+$\frac{0.9}{3}$Fe3O4,依据碳原子守恒得到x=0.1.
故答案为:0.1.
点评 本题考查了热化学方程式和盖斯定律的计算和应用,电解池电极反应的分析书写,化学平衡常数的计算,原子守恒氧化还原反应的计算应用,题目难度中等.

| A. | 3:11 | B. | 11:3 | C. | 2:3 | D. | 4:3 |
| 序号 | 实验内容 | 实验目的 |
| A | 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去 | 证明Na2CO3溶液中存在水解平衡 |
| B | 将Al泊插入浓硝酸中,无现象 | 证明Al和浓硝酸不反应 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向同体积同浓度的H2O2溶液中,分别加入1mL同浓度的CuSO4、FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
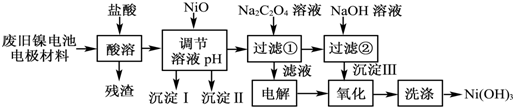
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
| A. | C8H10(芳香烃) | B. | 戊酸 | C. | C4H8Cl2 | D. | C4H8O2(酯) |
| A. | 硝酸溶液和氢氧化钠溶液 | B. | 氢氧化铁胶体溶液和盐酸溶液 | ||
| C. | 氢氧化钡溶液和硫酸溶液 | D. | 氢氧化钠和醋酸溶液 |