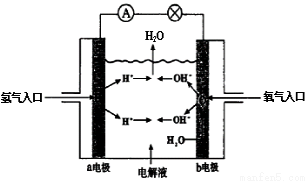
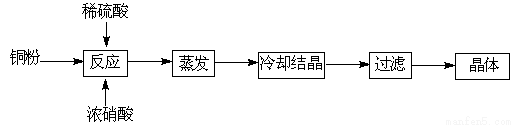
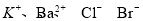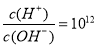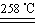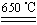题目内容
分别取两份a L含(NH4)2SO4和NH4NO3的混合液,一份用b mol NaOH并加热刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2。则原溶液中NO3-的物质的量浓度(单位mol·L-1)为
A.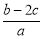 B.
B.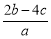 C.
C.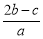 D.
D.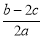
A
【解析】
试题分析:由题意知,b mol NaOH并加热刚好把NH3全部赶出,说明原溶液中有bmol的NH4+,与BaCl2溶液完全反应,消耗c mol BaCl2,说明原溶液中有cmol的,根据电荷守恒得n(NO3-)+2n(SO42-)=n(NH4+),所以n(NO3-)=b-2c,则原溶液中NO3-的物质的量浓度为(b-2c)/a,答案选A。
考点:考查溶液中离子浓度的计算、电荷守恒的应用

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目