题目内容
【题目】下列图示与对应的叙述相符的是( )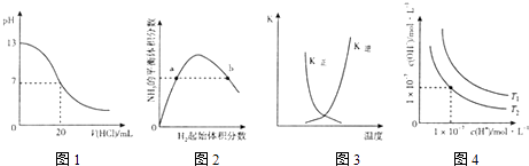
A.图1表示25℃时,用0.1mol L﹣1盐酸滴定20mL 0.1molL﹣1NaOH溶液,溶液的pH随加入酸体积的变化
B.图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
C.图3表示恒容密闭容器中反应“2SO2(g)+O2(g)2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化
D.图4表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
【答案】C
【解析】解:A.0.1molL﹣1NaOH溶液,pH=13,用盐酸滴定时,pH减小,滴定终点时pH发生突变,图中没有pH的突变,故A错误;
B.合成氨反应中,氢气越多,促进氮气的转化,氮气的转化率增大,则a点N2的转化率小于b点,故B错误;
C.△H<0为放热反应,交叉点正逆反应速率相等,为平衡点,之后升高温度平衡逆向移动,K正减小、K逆增大,图象合理,故C正确;
D.水的电离为吸热反应,图中T1时Kw大,则图中温度T2<T1 , 故D错误;
故选C.
【考点精析】关于本题考查的化学平衡状态本质及特征和酸碱中和滴定,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能得出正确答案.