题目内容
在(1)在前2 min内用FeCl2的浓度变化表示的平均反应速率是多少?
(2)在后4 min内用HCl浓度变化表示的平均反应速率是多少?
(3)前2 min与后4 min相比,反应速率哪个较快?为什么?
解析:Fe+2HCl![]() FeCl2+H2↑
FeCl2+H2↑
2 min末时:n(FeCl2)=n(H2)=![]() =0.05 mol,
=0.05 mol,
c(FeCl2)=![]() =0.5 mol·L-1
=0.5 mol·L-1
6 min末时:n(FeCl2)=n(Fe)=![]() =0.1 mol,c(FeCl2)=
=0.1 mol,c(FeCl2)=![]() =1.0 mol·L-1
=1.0 mol·L-1
(1)前2 min内:v(FeCl2)=![]() =0.25 mol·L-1·min-1
=0.25 mol·L-1·min-1
(2)后4 min内:v(FeCl2)=![]() =0.125 mol·L-1·min-1
=0.125 mol·L-1·min-1
v(HCl)=2v(FeCl2)=0.125 mol·L-1·s-1×2=0.25 mol·L-1·min-1
(3)选用v(FeCl2)比较,因为0.25 mol·L-1·min-1>0.125 mol·L-1·min-1,所以前2 min内反应速率快。原因:前2 min盐酸浓度较大。
答案:(1)v(FeCl2)=0.25 mol·L-1·min-1
(2)v(HCl)=0.25 mol·L-1·min-1
(3)前2 min内反应速率快。前2 min盐酸浓度较大。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解技术制取草酸。
Ⅰ、步骤④是减压抽滤(见下图),其优点是:__________________________________________, 当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是___________。
Ⅱ、该小组同学为了确定产品H2C2O4·xH2O中的的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和___________。
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:_____________________________。
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是__________
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大。为此,他们设计了实验进行探究:
【实验用品】 仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1 mol/L H2C2O4溶液、0.1 mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体。再在两支试管中各加入5滴0.1mol/LKMnO4溶液。现象如下(表1)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100 s | 90 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88 s | 100 s | 120 s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
实验(1)得出的结论是____________________________________________________。
(2)由实验(2)和实验(3)得出的结论是_________________________________________m___。
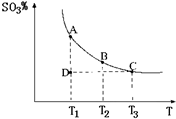 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
