题目内容
【题目】现有下列十种物质:①冰醋酸(CH3COOH) ②铝 ③CaCO3 ④干冰 ⑤H2SO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧液态氨气 ⑨稀硝酸 ⑩KAl(SO4)2 NaHSO4 Na2O
(1)以上物质属于非电解质的是__________,在熔融态不导电而水溶液中导电的电解质是__________(填序号)。
(2)写出⑩在水溶液中的电离方程式_____________________________________
(3)上述物质中两种物质之间发生反应可用离子方程式表示为:H++OH-=H2O的有_________________(填序号)。
(4)用食醋除水垢原理实质就是①溶液与③反应,写出该反应的离子方程式 ______。
(5)⑤的溶液和的离子反应方程式:_____________________________。
(6)若⑨溶液中含有⑤,如果除去杂质⑤所选的试剂是:_____________,离子方程式:_________________________________________________。
(7)将⑩和按一定的比例混合溶于水,测得混合溶液中H+和Al3+(假设Al3+无损耗)的物质的量浓度分别为0.2molL﹣1和0.4molL﹣1,则该混合混合溶液中SO42-的物质的量浓度为_____________。
(8)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,当有5.4g Al发生反应时,转移电子的数目为 ____________ 。
【答案】 ④⑧ ① ⑤ KAl(SO4)2==K++Al3++2SO42- CaCO3+2CH3COOH==Ca2++2CH3COO-+H2O+CO2↑ Na2O+2H+==2Na++H2O Ba(NO3)2, Ba2++SO42-==BaSO4↓ 1mol/L 0.6Na 或3.612x1023
【解析】(1)非电解质是指除电解质(酸碱盐和活泼金属氧化物)之外的化合物,所以为④⑧;熔融态不导电说明该物质为共价化合物,所以应该选择共价的电解质即①⑤
(2)KAl(SO4)2是一种盐,所以是强电解质,在水中完全电离为铝离子、钾离子和硫酸根离子,电离方程式为KAl(SO4)2==K++Al3++2SO42-。
(3)可用离子方程式表示为:H++OH-![]() H2O的方程式一定是强酸和强碱的中和反应,本题的强酸碱为硫酸、氢氧化钡、稀硝酸。因为硫酸和氢氧化钡反应还有硫酸钡沉淀生成,所以不正确,答案只能为氢氧化钡和稀硝酸的反应。
H2O的方程式一定是强酸和强碱的中和反应,本题的强酸碱为硫酸、氢氧化钡、稀硝酸。因为硫酸和氢氧化钡反应还有硫酸钡沉淀生成,所以不正确,答案只能为氢氧化钡和稀硝酸的反应。
(4)碳酸钙与醋酸反应生成醋酸钙、水和二氧化碳,其中碳酸钙不溶于水,醋酸是一种弱电解质,水是弱电解质,二氧化碳是非电解质,都不能拆分成离子,只有醋酸钙属于强电解质可以拆开。
(5)化学方程式为:Na2O+H2SO4==Na2SO4+H2O,将硫酸和硫酸钠拆分为离子即得对应的离子方程式。
(6)硝酸中有硫酸杂质,可以选择加入适量的硝酸钡,使硫酸转化为硫酸钡沉淀和硝酸,再过滤除去。
(7)溶液为KAl(SO4)2和NaHSO4 的混合溶液。其中H+的物质的量浓度为0.2mol/L,所以NaHSO4 的物质的量浓度为0.2mol/L,NaHSO4 的SO42-的浓度为0.2mol/L。Al3+的物质的量浓度为0.4molL﹣1,则KAl(SO4)2的物质的量浓度为0.4mol/L,KAl(SO4)2的SO42-的浓度为0.8mol/L,所以SO42-的总浓度为1mol/L.
(8)反应中转移电子的数目等于得电子数目也等于失电子数目。反应中单质铝转化为硝酸铝,化合价由0升高至+3,每1mol Al失去3mol电子。5.4gAl为0.2mol,所以失电子为0.6mol,转移电子也是0.6mol,即0.6NA。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。
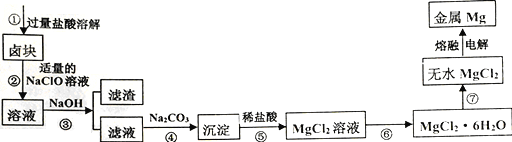
本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。