��Ŀ����
�ɼ��ֳ������λ����ɵİ�ɫ��ĩ������ֻ���ܺ���Na����K����Al3����CO32����HCO3����SO42����NO2���е����������ӡ�ijͬѧ�Ը���Һ��������ʵ�飺
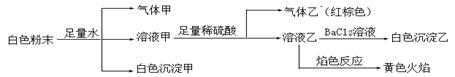
����˵����ȷ����

����˵����ȷ����
| A����ɫ��������Al(OH)3���������CO2�����Ի����һ����Al3����HCO3�� |
| B��������һ����NO��NO2�Ļ������ |
| C����ɫ��������BaSO4������ԭ�����һ������SO42�� |
| D����ɫ��ĩ��һ������Na�� ��Al3�� ��NO2�� |
D
�����������Ϊ�ڰ�ɫ��ĩ�м���������ˮ����������塢��ɫ������˵�������ܹ�˫ˮ����������һ������Al3��������˫ˮ���������HCO3������CO32-����ȷ�����������CO2����������Al(OH)3�������ڰ�ɫ��ĩ�м���������в���NaԪ�أ�����Һ�ҵ���ɫ��ӦΪ��ɫ��˵����ԭ������Һ�к���Na��������Һ���м���������ϡ��������������Ǻ���ɫ��˵��ԭ��Һ�к���NO2�����ӡ����ڼ�����ϡ���ᣬ�������ԭ������Һ���Ƿ���SO42�����ӣ���Һ����һ������SO42���������Һ�м���BaCl2��Һʱ�����BaSO4�����������������û����һ�����е�������Na�� ��Al3�� ��NO2����ѡ��ΪD��

��ϰ��ϵ�д�
�����Ŀ




 Mg2����2OH�����������������ʹMg(OH)2(s)��������(����)
Mg2����2OH�����������������ʹMg(OH)2(s)��������(����)