��Ŀ����
����Ŀ��������ԭ��Ӧ��������������Ӧ�ù㷺������ѧ֪ʶ�ش����⣺
��1���ظ����[��NH4��2Cr2O7]���ȷ���������ԭ��Ӧ�����и����ظ�������ȷֽ������жϷ���ʵ�ʵ����� ��
A.CrO3+NH3+H2O
B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O
D.Cr2O3+N2+H2O
��2��ȡ300mL 0.2mol/L��KI��Һ��һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3 �� KMnO4����ԭ��Mn2+ �� �÷�Ӧ�����ӷ���ʽΪ
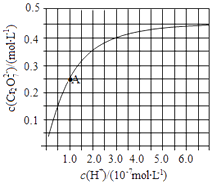
��3��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȣ���仯�ɱ���Ϊ��2KClO3+4HCl��Ũ���T2KCl+2ClO2��+Cl2��+2H2O��
a��������÷�Ӧ�е���ת�Ƶ�����������ŷ���ʾ���� ��
b����ԭ���뻹ԭ��������ʵ���֮��Ϊ ��
c��Ũ�����ڷ�Ӧ����ʾ������������ �� ����д��ţ�
��ֻ�л�ԭ�ԣ��ڻ�ԭ�Ժ����ԣ���ֻ�������ԣ��������Ժ����ԣ�
d������0.1mol Cl2 �� ��ת�Ƶĵ��ӵ����ʵ���Ϊmol��
���𰸡�
��1��D
��2��15I��+8MnO4��+34H+=5I2+5IO3��+8Mn2++17H2O
��3��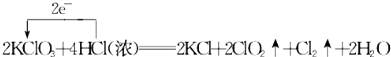 ,1��1,��,0.2
,1��1,��,0.2
���������⣺��1���ظ����[��NH4��2Cr2O7]��һ�������ֽ���Σ��ֽ�ʱ����������ԭ��Ӧ��NԪ�صĻ��ϼ�Ӧ���ߣ�CrԪ�صĻ��ϼ�Ӧ���ͣ�
��NԪ���ɩ�3�ۿ�������Ϊ0�ۣ�CrԪ�صĻ��ϼ���+6�۽���Ϊ+3�ۣ�ֻ��D�������⣬
��ѡ��D��
��2��n��KI��=0.06mol����һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3����n��I2��=n��KIO3��=0.02mol�����Է���ʽΪ��15I��+8MnO4��+34H+=5I2+5IO3��+8Mn2++17H2O��
�ʴ�Ϊ��15I��+8MnO4��+34H+=5I2+5IO3��+8Mn2++17H2O��
��3��a��KClO3����Ԫ�ػ��ϼ���+5�۽���ΪClO2��+4�ۣ����ϼ۽���1�ۣ�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����ϼ�����2�ۣ������ת�Ƶķ������ĿΪ�� 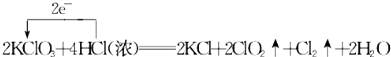 ��b��KClO3��Ԫ�صĻ��ϼ۽��ͣ�����������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����ϼ����ߣ���Ԫ�ر����������������뻹ԭ�������ʵ���֮��Ϊ1��1��c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룻d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����Բ���0.1molCl2��ת�Ƶĵ��ӵ����ʵ���Ϊ0.1mol��2=0.2mol��
��b��KClO3��Ԫ�صĻ��ϼ۽��ͣ�����������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����ϼ����ߣ���Ԫ�ر����������������뻹ԭ�������ʵ���֮��Ϊ1��1��c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룻d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����Բ���0.1molCl2��ת�Ƶĵ��ӵ����ʵ���Ϊ0.1mol��2=0.2mol��
�ʴ�Ϊ��0.2mol�� 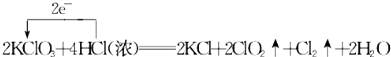 ��1��1���ڡ�
��1��1���ڡ�
��1����ѧ��ӦҪ����ԭ���غ㡢����غ㣬�����غ㡣�ظ���立ֽⷢ��������ԭ��Ӧ����NԪ���ɩ�3�ۿ�������Ϊ0�ۣ�CrԪ�صĻ��ϼ���+6�۽���Ϊ+3�ۣ�����������ԭ��Ӧ�е���ת���غ�Ĺ��ɣ���2������ؼ������ɵ����ʵ�����I2��KIO3����3��a���������ɻ�ԭ��ָ����������д�����ӵ���Ŀ��b�������õ��ĵ��������ڻ�ԭ��ʧȥ�ĵ����������������뻹ԭ�������ʵ���֮��Ϊ1��1��c������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������Ϊ��ԭ������һ����HClû�����������ñ���Ϊ���ԣ�d��ת�Ƶĵ��ӵ����ʵ���Ϊ����ԭ�ӵ����ʵ������۲�
��

 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����H��0�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������ǣ� ��
ѡ�� | x | y |
A | MgSO4����������������� | CO��ת���� |
B | CO�����ʵ��� | CO2��CO�����ʵ���֮�� |
C | SO2��Ũ�� | ƽ�ⳣ��K |
D | �¶� | �����ڻ��������ܶ� |

A.A
B.B
C.C
D.D
����Ŀ����50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ� 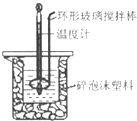
��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� | |||
HCl | NaOH | ƽ��ֵ | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��1���ڸ�ʵ���У���ȡ50mL�����NaOH��Һ����Ҫ�õ��IJ���������
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ������
��3��ijͬѧʵ���¼���������ϱ���ʾ�����м�¼����ֹ�¶���ָ�¶ȣ�
��4�������ʵ�鷢���кͷ�Ӧʱ�ų�������ΪkJ[�кͺ����ɵ���Һ�ı�����c=4.18J��g�棩��1 �� ϡ��Һ���ܶȶ�Ϊ1gcm��3]��
��5�������50mL 0.55mol/L�İ�ˮ��NH3H2O������NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����к��ȡ�H��ƫ����ԭ���� ��