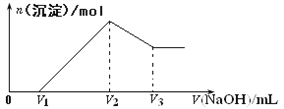
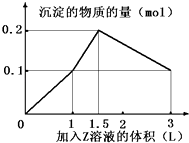
题目内容
【题目】下列说法正确的是
A. 常温下SiO2与碳酸钠溶液反应生成CO2
B. 通过反应Na2SiO3+2HCl![]() 2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C. 因为硅酸难溶于水,所以它不能与NaOH溶液反应
D. 硅胶可用作袋装食品的干燥剂
【答案】D
【解析】A.常温下SiO2与碳酸钠溶液不反应,在高温下,SiO2与碳酸钠固体能够反应生成硅酸钠和二氧化碳,故A错误;B.硅酸盐能和酸性大于硅酸的酸反应生成硅酸,所以由反应Na2SiO3+2HCl═2NaCl+H2SiO3↓制取硅酸是利用了强酸可以制弱酸的性质,故B错误;C.硅酸能与NaOH溶液反应生成硅酸钠,故C错误;D.硅胶具有多孔结构,具有吸附性,可用作袋装食品的干燥剂,故D正确;故选D。

【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构. 
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
依据表数据列式计算该NaOH溶液的物质的量浓度(保留两位有效数字)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
依据表数据列式计算该NaOH溶液的物质的量浓度(保留两位有效数字)
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)