题目内容
下列说法正确的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO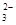 )+c(HCO
)+c(HCO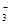 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的
c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10, Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO
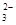 )+c(HCO
)+c(HCO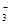 )]
)]③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的
c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10, Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
| A.①④ | B.②③ | C.①③ | D.②④ |
C
试题分析:①两者的浓度之比等于物质的量之比,稀释时,促进碳酸氢根离子的电离和水解,碳酸氢根离子的物质的量减小,钠离子的物质的量不变,故两者的比值增大,①正确;②溶液中含碳的微粒还有碳酸分子,故②错误;③恰好完全中和时生成氯化铵溶液,溶液中的氢离子是水电离出的,由水电离出的氢离子等于由水电离生成的氢氧根离子,故③正确;④有Ksp的表达式可以求出溶液中离子的浓度,根据离子浓度比较,重铬酸钾溶液中离子浓度大,故溶解度大,④错误;故选C。

练习册系列答案
相关题目

 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是


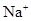 )>c(
)>c(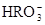 )>c(
)>c(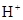 )>c(
)>c(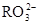 )>c(
)>c(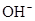 )
)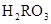 )=c(
)=c(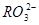 )分别相等
)分别相等

 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)