题目内容
【题目】下列有关物质性质与用途具有对应关系的是
A. MnO2不溶于水,可用作H2O2分解的催化剂
B. SO2具有漂白性,可用于制溴工业中吸收Br2
C. FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D. NH4NO3分解产生大量气体,可用作汽车安全气囊产气药
【答案】D
【解析】A、MnO2不溶于水,与作H2O2分解的催化剂之间没有因果关系,则A错误;B、SO2用于制溴工业中吸收Br2,是利用SO2的还原性,与漂白性无关,故B错误;C、FeCl3溶液用于蚀刻铜制的电路板,是利用Fe3+的氧化性,与溶液的酸性没有关系,故C错误;D、NH4NO3分解能产生大量气体,可用作汽车安全气囊产气药,则D正确。故本题正确答案为D。

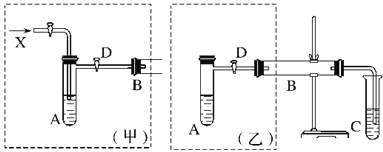
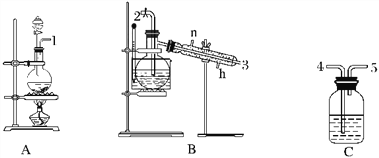
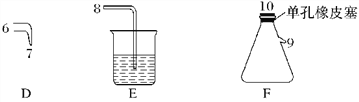
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为71 ℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃爆炸,热水中能与水反应 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→____________________________________。
(2)C装置作用是_________________________________________________________________。
(3)B装置中发生反应的化学方程式为____________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________________。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60 ℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:___________________________________________。