题目内容
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
回答下列问题:
(1)浓盐酸在反应中显示出来的性质是________(填字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为____________mol。
(3)此反应的离子方程式为_____________________。
(4)用双线桥法标出该反应的电子转移的方向和数目:_________________________。
(5)配平化学方程式:______KMnO4+_______HC1(浓)=_______KCl+_______MnCl2+_______Cl2↑+______H2O
【答案】(1)B;(2)0.3;(3)ClO-+Cl-+2H+=C12↑+H2O;
(4)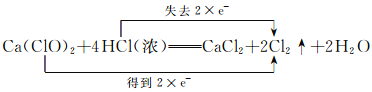 ;
;
(5)2,16,2 ,2 ,5 ,8 。
【解析】
试题分析:(1)浓盐酸中一部分Cl失去电子转化成Cl2,表现还原性,一部分表现酸性,转化成CaCl2,故选项B正确;(2)生成2mol氯气时,转移的物质的量2mol电子,因此生成0.3mol氯气转移电子物质的量为0.3×2/2mol=0.3mol;(3)此反应的离子反应方程式为:ClO- +Cl- +2H+=C12↑+H2O;(4)根据(2)中分析,ClO2-得到电子转化成氯气,因此双线桥的表示形式是:
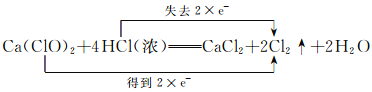 ;
;
(5)KMnO4中Mn由+7价→+2价,化合价降低5价,HCl中Cl-由-1价→0,化合价升高1价,最小公倍数为5,然后根据原子守恒,配平其他,即2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。

练习册系列答案
相关题目