题目内容
A、B是同一短周期的两种金属元素,若aAm+离子半径大于bBn+离子半径,则下列比较正确的是( )
| A、金属性:A<B |
| B、氧化性:Am+>Bn+ |
| C、m>n |
| D、a<b |
考点:微粒半径大小的比较,原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A、B是同一短周期的两种金属元素,其阳离子核外电子排布相同,若aAm+离子半径大于bBn+离子半径,则原子序数a<b,A在B的前面,结合元素周期表与周期律然后逐项分析.
解答:
解:A、B是同一短周期的两种金属元素,其阳离子核外电子排布相同,若aAm+离子半径大于bBn+离子半径,则原子序数a<b,A在B的前面;
A.同一周期从左到右,元素的金属性逐渐减弱,则金属性:A>B,故A错误;
B.元素的金属性越强,对应阳离子的氧化性越弱,则氧化性:Am+<Bn+,故B错误;
C.最高化合价等于最外层电子数,所以离子所带电荷数:m<n,故C错误;
D.核外电子排布相同时,原子序数越小,半径越大,则原子序数a<b,故D正确.
故选D.
A.同一周期从左到右,元素的金属性逐渐减弱,则金属性:A>B,故A错误;
B.元素的金属性越强,对应阳离子的氧化性越弱,则氧化性:Am+<Bn+,故B错误;
C.最高化合价等于最外层电子数,所以离子所带电荷数:m<n,故C错误;
D.核外电子排布相同时,原子序数越小,半径越大,则原子序数a<b,故D正确.
故选D.
点评:本题考查原子结构与元素的性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握原子结构特点以及元素周期律的递变规律.

练习册系列答案
相关题目
阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为
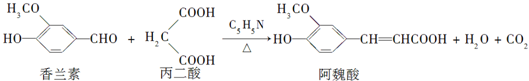
下列说法正确的是( )

下列说法正确的是( )
| A、可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 |
| B、与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种 |
| C、通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D、香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 |
下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去苯中少量的苯酚:滴加适量溴水,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去苯中少量的甲苯:加足量KMnO4溶液,分液.
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去苯中少量的苯酚:滴加适量溴水,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去苯中少量的甲苯:加足量KMnO4溶液,分液.
| A、①②③ | B、②③④ |
| C、②④⑤ | D、③④⑤ |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:
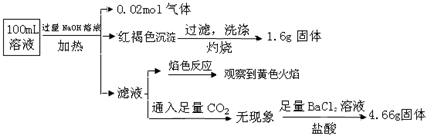
由此可知原溶液中( )

由此可知原溶液中( )
| A、原溶液中c(Fe3+)=0.2mol?L-1 |
| B、溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol?L-1 |
| C、SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 |
| D、要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
下列实验不能达到实验目的是( )
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R-X是碘代烷,把R-X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可.
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R-X是碘代烷,把R-X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可.
| A、①②③④⑤ | B、①③④ |
| C、①②③⑤ | D、②③⑤ |
下列实验能获得成功的是( )
| A、在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯 |
| B、用溴水可鉴别苯、CCl4、苯乙烯 |
| C、鉴定溴乙烷中存在溴元素的实验操作是先加入NaOH溶液,加热后再加入AgNO3溶液 |
| D、配制银氨溶液时,将硝酸银溶液逐滴加入到稀氨水中 |
在中和热的测定实验中,使用下列用品不是为了减少实验误差的是( )
| A、碎泡沫塑料 |
| B、环形玻璃搅拌棒 |
| C、底部垫纸条 |
| D、两个量筒 |
根据氢原子和氯原子的核外电子排布,对Cl2和HCl分子中形成的共价键描述正确的( )
| A、两者都为s-sσ键 |
| B、两者都为p-pσ键 |
| C、前者为p-pσ键,后者为s-pσ键 |
| D、前者为s-sσ键,后者为s-pσ键 |
下列实验现象描述正确的是( )
| A、NaOH溶液中滴入酚酞试液,溶液呈无色 |
| B、品红溶液中通入SO2气体,溶液呈紫色 |
| C、FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| D、新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |