题目内容
【题目】被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:TiO2+2C+2Cl2═TiCl4+2CO
(1)用双线桥法标出上述化学方程式的电子转移情况;
(2)指出该反应的氧化剂 , 氧化产物;
(3)当消耗标准状况下Cl211.2L时,则转移的电子数为 .
【答案】
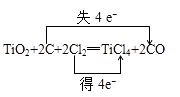
(1)
(2)Cl2,CO
(3)NA
【解析】解:(1)在反应中,C元素的化合价由0升高到+2价,失电子数目是2,Cl元素的化合价由0降低为﹣1价,得到电子数目共为2,电子转移情况如下: 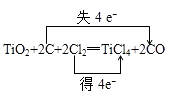 ;
;
(2)Cl元素的化合价降低,C元素的化合价升高,则Cl2为氧化剂,C为还原剂,CO是氧化产物;
(3)根据化学方程式,当消耗2mol氯气单质时,转移的电子为4mol,当消耗标准状况下Cl211.2L即0.5mol时,转移的电子为1mol,个数是NA.
故答案为:(1) ;(2)Cl2;CO;(3)NA
;(2)Cl2;CO;(3)NA
(1)用双线桥表示电子转移时,箭头指向的为同一种元素,其转移电子数可从化合价变化得出。
(2)在反应过程中,有元素化合价降低的物质为氧化剂;有元素化合价升高的反应为氧化反应,其所得产物为氧化产物。
(3)根据公式![]() 计算氯气的物质的量,再结合公式2Cl2~4e-计算转移电子数。
计算氯气的物质的量,再结合公式2Cl2~4e-计算转移电子数。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
【题目】下列实验与对应示意图的关系正确的是( )
A | B | C | D |
NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
|
|
|
|
A.A
B.B
C.C
D.D