题目内容
(1)已知下列反应:
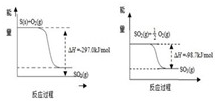
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ?mol-1 ①
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ?mol-1 ②
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1③
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 ④
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为
(2)NH4Cl溶液显 性,原因是(用离子方程式表示)
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;
(4)已知水存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 .
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol?L-1]
D.向水中加入 (NH4)2SO4固体
(5)若等浓度、等体积的NaOH溶液和NH3?H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m n (填“<”、“>”或“=”).
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ?mol-1 ①
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ?mol-1 ②
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1③
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 ④
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为
(2)NH4Cl溶液显
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=
(4)已知水存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol?L-1]
D.向水中加入 (NH4)2SO4固体
(5)若等浓度、等体积的NaOH溶液和NH3?H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m
分析:(1)根据题中热化学方程式及盖斯定律整理出S(g)与O2(g)反应生成SO2(g)的热化学方程式;
(2)氯化铵属于强酸弱碱盐,根据盐的水解分析溶液酸碱性;写出铵离子水解的离子方程式;
(3)醋酸钠为强碱弱酸盐,醋酸钠溶液中的氢氧根离子来自水的电离;
(4)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(5)根据一水合氨为弱电解质,不能完全电离,溶液中氢氧根离子浓度小于氢氧化钠溶液中氢氧根离子浓度分析.
(2)氯化铵属于强酸弱碱盐,根据盐的水解分析溶液酸碱性;写出铵离子水解的离子方程式;
(3)醋酸钠为强碱弱酸盐,醋酸钠溶液中的氢氧根离子来自水的电离;
(4)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(5)根据一水合氨为弱电解质,不能完全电离,溶液中氢氧根离子浓度小于氢氧化钠溶液中氢氧根离子浓度分析.
解答:解:(1)根据盖斯定律,④+③-①-②可得:2S(g)+2O2(g)=2SO2(g)△H=-1147.64kJ?mol-1,即S(g)+O2(g)=SO2(g)△H=-573.8kJ?mol-1,
故答案为:S(g)+O2(g)=SO2(g)△H=-573.8kJ?mol-1;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度,水解离子方程式为:NH4++H2O?NH3?H2O+H+,溶液呈酸性,
故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)常温下,pH=11的CH3COONa溶液中氢氧根离子浓度为:c(OH-)=0.001mol/L,醋酸根离子结合水电离的氢离子,促进了水的电离,醋酸钠溶液中的氢氧根离子就是水电离的,所以c水电离出来的c(OH-)=0.001mol/L,
故答案为:0.001mol/L;
(4)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(5)氨水为弱电解质,不能完全电离;等浓度、等体积的NaOH溶液和NH3?H2O溶液,氢氧化钠溶液中氢氧根离子浓度大,若稀释后溶液的pH相等,氢氧化钠溶液稀释的体积一定大于氨水氨水溶液体积,
故答案为:>.
故答案为:S(g)+O2(g)=SO2(g)△H=-573.8kJ?mol-1;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度,水解离子方程式为:NH4++H2O?NH3?H2O+H+,溶液呈酸性,
故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)常温下,pH=11的CH3COONa溶液中氢氧根离子浓度为:c(OH-)=0.001mol/L,醋酸根离子结合水电离的氢离子,促进了水的电离,醋酸钠溶液中的氢氧根离子就是水电离的,所以c水电离出来的c(OH-)=0.001mol/L,
故答案为:0.001mol/L;
(4)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(5)氨水为弱电解质,不能完全电离;等浓度、等体积的NaOH溶液和NH3?H2O溶液,氢氧化钠溶液中氢氧根离子浓度大,若稀释后溶液的pH相等,氢氧化钠溶液稀释的体积一定大于氨水氨水溶液体积,
故答案为:>.
点评:本题考查较为综合,涉及酸碱混合的定性判断和计算、弱电解质的电离、盐类的水解等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目