题目内容
12.下列物质属于离子化合物的是( )| A. | HCl | B. | Na2O | C. | O2 | D. | CO |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.HCl分子中只存在共价键,为共价化合物,故A错误;
B.氧化钠中钠离子和氧离子之间只存在离子键,为离子化合物,故B正确;
C.氧气分子中O-O原子之间只存在共价键,为单质,故C错误;
D.CO分子中C-O原子之间只存在共价键,为共价化合物,故D错误;
故选B.
点评 本题考查离子化合物的判断,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,注意离子化合物和共价化合物的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择不正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 渗析 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
3.下列实验设计或操作不合理的是( )
| A. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| B. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| C. | 将乙醇和浓硫酸按体积比1:3混合加热到170℃制乙烯 | |
| D. | 实验室制乙炔时,为了减慢反应速率,可用饱和食盐水代替蒸馏水 |
20.下列物质的各原子最外层电子数都达到8个电子的是( )
| A. | BeF2 | B. | SiCl4 | C. | CH4 | D. | SF6 |
7.有机物阿魏酸的化学式为C10H10O4.符合下列条件的阿魏酸的同分异构体有( )
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.实验设计和判断.为了研究过氧化氢分解速率,请回答下列问题.
(1)填写实验报告(填写空白处)
(2)过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
(1)填写实验报告(填写空白处)
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
2.下已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键完全断裂时吸收热量为( )
| A. | 932kJ | B. | 496kJ | C. | 738 kJ | D. | 248 kJ |
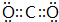 ,BA2分子中化学键属于共价键..
,BA2分子中化学键属于共价键.. .
.