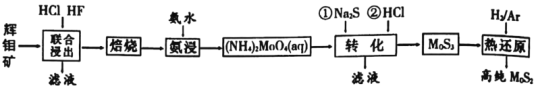题目内容
【题目】下列物质及用途组合错误的是( )
A. 乙醇—清洁燃料B. 漂粉精—杀菌消毒
C. 明矾—净水剂D. 电石—制甲烷的原料
【答案】D
【解析】
A.乙醇具有可燃性,燃烧时生成二氧化碳和水,同时放出大量的热量,可用作清洁燃料,故A正确;
B.漂粉精的有效成分为次氯酸钙,次氯酸钙能反应生成具有强氧化性的HClO,HClO能够杀菌消毒,故B正确;
C.明矾电离的铝离子能发生水解反应生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能够吸附水中的悬浮杂质,因此可用作净水剂,故C正确;
D.实验室用饱和食盐水和电石反应制乙炔,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,实验室制取甲烷,可用无水醋酸钠(CH3COONa)和碱石灰的混合物加热来制取,反应的化学方程式如下:CH3COONa+NaOH![]() Na2CO3+CH4↑,故D错误。
Na2CO3+CH4↑,故D错误。
故选D。

练习册系列答案
相关题目
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应