题目内容
设阿伏加德罗常数为NA,下列说法正确的是( )
分析:A、根据n=
计算混合气体的物质的量,根据N=nNA计算分子数目,二者都是双原子分子,原子数目是分子数目的2倍;
B、反应中H元素的化合价由+1价降低为0价,据此根据氢气的物质的量计算转移电子的物质的量,再根据N=nNA计算转移电子数目;
C、氦气是单原子分子,每个氦气分子含有2个电子;
D、NO与氧气不能共存,反应生成二氧化氮,二氧化氮和四氧化二氮存在化学平衡,据此分析判断.
| V |
| Vm |
B、反应中H元素的化合价由+1价降低为0价,据此根据氢气的物质的量计算转移电子的物质的量,再根据N=nNA计算转移电子数目;
C、氦气是单原子分子,每个氦气分子含有2个电子;
D、NO与氧气不能共存,反应生成二氧化氮,二氧化氮和四氧化二氮存在化学平衡,据此分析判断.
解答:解:A、标准状况下,11.2L以任意比混合的氮气和氧气的物质的量为
=0.5mol,分子数目为0.5NA,二者都是双原子分子,原子数目是分子数目的2倍为NA,故A正确;
B、反应中H元素的化合价由+1价降低为0价,故生成0.1molH2,则转移的电子数为0.1mol×2×NAmol-1=0.2NA,故B错误;
C、氦气是单原子分子,每个氦气分子含有2个电子,故1mol氦气含有的核外电子数为2NA,故C错误;
D、标准状况下,NA个NO分子为1mol,0.5NA个O2分子为0.5mol,混合后反应2NO+O2=2NO2,生成二氧化氮为1mol,二氧化氮和四氧化二氮存在化学平衡2NO2?N2O4,反应后的气体的物质的量小于中分子总数小于1mol,故标准状况下体积小于22.4L,故D错误;
故选A.
| 11.2L |
| 22.4L/mol |
B、反应中H元素的化合价由+1价降低为0价,故生成0.1molH2,则转移的电子数为0.1mol×2×NAmol-1=0.2NA,故B错误;
C、氦气是单原子分子,每个氦气分子含有2个电子,故1mol氦气含有的核外电子数为2NA,故C错误;
D、标准状况下,NA个NO分子为1mol,0.5NA个O2分子为0.5mol,混合后反应2NO+O2=2NO2,生成二氧化氮为1mol,二氧化氮和四氧化二氮存在化学平衡2NO2?N2O4,反应后的气体的物质的量小于中分子总数小于1mol,故标准状况下体积小于22.4L,故D错误;
故选A.
点评:考查常用化学计量的有关计算等,难度中等,选项D为易错点,注意二氧化氮和四氧化二氮存在化学平衡.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
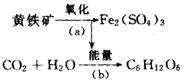 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下: