题目内容
(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
请根据要求回答下列问题:
(1) 写出该反应的化学方程式
(2)此反应中浓硫酸的作用是
饱和碳酸钠的作用是
(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为 ,不过往往产率偏低,其原因可能为 (任填2种)
(1)CH3COOH+CH3CH2OH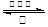 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(2)催化剂和吸水剂;溶解乙醇、吸收乙酸、降低乙酸乙酯溶解度
(3)CH3COOCH2CH3 、 CH3CH2OH
(4)出现分层现象,上层为无色油状液体;
温度过高,发生了副反应;冷凝效果不好,部分原料被蒸出(或部分产物挥发)(任填两种)。
解析试题分析:本题考查乙酸乙酯的实验室制法。
(1)反应方程式为CH3COOH+CH3CH2OH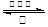 CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(2)浓硫酸作用是催化剂和吸水剂,产生的乙酸乙酯通入饱和碳酸钠溶液中,饱和碳酸钠溶液的作用有溶解乙醇、中和乙酸、降低乙酸乙酯的溶解度,使乙酸乙酯分层析出。
(3)乙醇与乙酸发生酯化反应时,乙酸提供羟基、乙醇提供H形成水,酯水解时断裂酯基中的碳氧单键,所以含有18O的物质有乙醇乙酯和乙醇。
(4)乙酸乙酯不溶于水且密度比水小,所以锥形瓶中出现分层现象,上层为无色油状液体;产率偏低的原因可能有:温度过高,发生了副反应;冷凝效果不好,部分原料被蒸出;部分产物挥发等。
考点:乙酸乙酯的实验室制法 酯化反应机理
点评:大多数酯化反应的机理:酸脱羟基醇脱氢。

 阅读快车系列答案
阅读快车系列答案(分)苯甲酸甲酯:
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g·cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(![]() )是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
)是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
有关物质的物理性质见右表。
Ⅰ苯甲酸甲酯的合成和提纯。
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应;第二步:水洗提纯;第三步:蒸馏提纯。
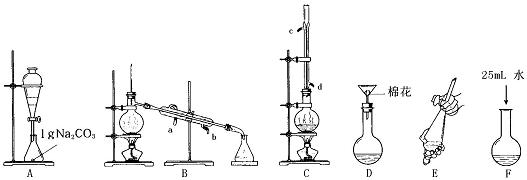
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有15.0g苯甲酸和20.0mL过量的甲醇外,还需要加入___________、______________ 。
(3)步聚F向酯化完成后,卸下的烧瓶中加入25mL水的作用是_____ ___ _ __;A装置中固体Na2CO3作用是_______ __。
(4)步骤E的操作要领是 。
(5)装置A的分液漏斗中液体分为两层,苯甲酸甲酯应在 (填上、下)层;B装置蒸馏时,接收苯甲酸甲酯前(温度<199.6℃)锥形瓶中得到的物质是 。
(Ⅱ)苯甲酸甲酯的皂化反应
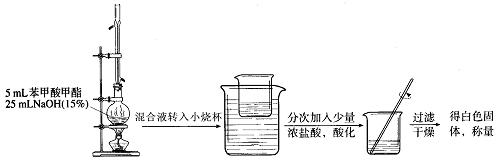
① ② ③
(6)装置①中冷凝管的作用是: ;
能说明①装置中反应完全的现象是_____________。
(7) 在③中得到白色固体的质量为5.9g。假设反应(Ⅰ)和反应(Ⅱ)中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,其它步骤的转化效率为100%,请计算酯化反应中苯甲酸的转化率,写出简要计算过程:











 是否互为同分异构体
是否互为同分异构体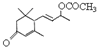 的同分异构体有
的同分异构体有
