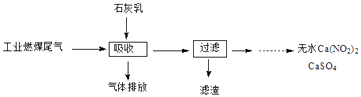
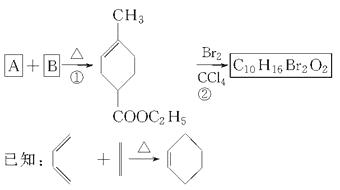
题目内容
【题目】100mL 2.0 molL﹣1 的碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,最终都有气体产生,但生成的气体体积不同,下列选项中盐酸的浓度合理的是( )
A.2.0 molL﹣1
B.1.5 molL﹣1
C.1 molL﹣1
D.0.5 molL﹣1
【答案】B
【解析】解:当碳酸钠滴入盐酸中时发生CO32﹣+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,反应顺序为CO32﹣+H+═HCO3﹣、HCO3﹣+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,
所以1<n(HCl):n(Na2CO3)<2,n(Na2CO3)=2.0mol/L×0.1L=0.20mol,则0.2mol<n(HCl)<0.4mol,
盐酸的体积是200mL,所以 ![]() <c(HCl)<
<c(HCl)< ![]() ,
,
即1mol/L<c(HCl)<2mol/L,
故选B.

【题目】某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是 .
(2)固体成分的初步确定.
实验序号 | 操作及现象 |
ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
①由上述实验可知:溶液中Fe元素的存在形式有
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)
③生成O2的化学方程式是
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4 .
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
实验序号 | 操作、现象 |
ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; |
ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2 , |
提示:KSCN中S元素的化合价为﹣2价
①实验ⅲ中白色沉淀的化学式是
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是
③查阅资料得知:Cl﹣对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是 .