题目内容
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
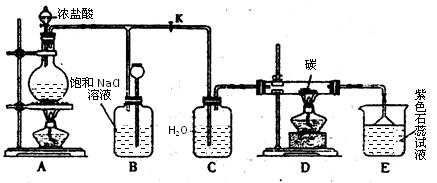
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)2Cl2+C+2H2O![]() CO2+4HCl 提供反应需要的H2O
CO2+4HCl 提供反应需要的H2O
(3)先变红,后褪色 D中生成HCl使溶液变红,而剩余的Cl2生成的HClO使红色溶液褪色.
(4)B
(5)B中液面下降,长颈漏斗内液面升高 安全装置,使内压降低
解析:
略

练习册系列答案
相关题目
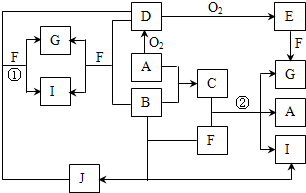 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O