题目内容
【题目】如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( ) 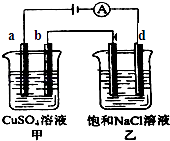
A.甲烧杯中a极上最多可析出铜0.64g
B.甲烧杯中b极上电极反应式4OH﹣﹣4e﹣═2H2O+O2↑
C.乙烧杯中滴入酚酞试液,d极附近先变红
D.烧杯中c极上电极反应式为4H++4e﹣═2H2↑
【答案】C
【解析】解:A.A极(阳极)反应式为4OH﹣﹣4e﹣=2H2O+O2↑,生成氧气,不能析出铜,故A错误;
B.甲烧杯中B极上电极反应式为:Cu2++2e﹣=Cu,故B错误;
C.d极(阴极)反应式为2H++2e﹣=H2↑,由于H+放电,打破了水的电离平衡,导致d极附近溶液呈碱性(有NaOH生成),故C正确;
D.烧杯中c极上电极反应式为2Cl﹣﹣2e﹣=Cl2↑,故D错误;
故选C.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目





