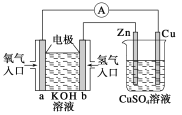
题目内容
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验.请回答下列问题:
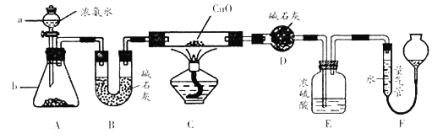
(1)仪器a的名称为___________;仪器b中可选择的试剂为___________。
(2)实验室中,利用装置A,还可制取的无色气体是________________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有___________性,写出相应的化学方程式________________。
(4)E装置中浓硫酸的作用________________。
(5)读取气体体积前,应对装置F进行的操作:________________。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比值为___________(用含m、n字母的代数式表示)。
【答案】(1)分液漏斗、生石灰(氧化钙或氢氧化钠固体或碱石灰);
(2)BC;(3)还原;3CuO+2NH3![]() 3Cu+3H2O+N2;
3Cu+3H2O+N2;
(4)吸收未反应的氨气,阻止F中水蒸气进入D;
(5)慢慢上下移动右边漏斗,使左右两管液面相平;(6)![]()
【解析】
试题分析:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体;
(2)利用装置A,可制取的无色气体;A.制备氯气Cl2需要加热,且氯气为黄绿色气体,A不符合;B.可以制备O2,利用固体过氧化钠和水的反应,B符合;C.可以制备CO2 气体,利用稀盐酸滴入大理石上反应生成,C符合;D.NO2是红棕色气体,D不符合;答案选BC;
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3![]() 3Cu+3H2O+N2;
3Cu+3H2O+N2;
(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果;
(5)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;
(6)若测得干燥管D增重mg为水物质的量=![]() ,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=
,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=![]() ,依据元素守恒得到氮原子和氢原子物质的量之比=
,依据元素守恒得到氮原子和氢原子物质的量之比=![]() ×2:
×2:![]() ×2=
×2=![]() ,则氨分子中氮、氢的原子个数比为
,则氨分子中氮、氢的原子个数比为![]() 。
。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】如图所示,密闭筒形容器中,有活塞位于距全长一端1/5处,左边为空气,右边为H2、O2混合气体,标准状况下,若将H2、O2混合气体点燃引爆,活塞先左弹,恢复到原来温度后,活塞右滑停留在筒的中央,则原来H2、O2的物质的量比可能为 ( )
空气 | H2、O2的混合气 |
A. 7:1 B. 1:1 C. 1:3 D. 4:1
【题目】利用如图所示装置分别盛放相应物质进行下列实验,得出结论正确的是
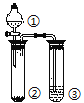
选项 | ① | ② | ③ | 判定结论 |
A | 浓硫酸 | 蔗糖 | 溴水 | 用来判定浓硫酸具有脱水性、氧化性 |
B | 稀盐酸 | Na2SO3 | Ba(NO3)2 | 用来判定SO2与可溶性钡盐均可生成白色沉淀 |
C | 浓盐酸 | Na2CO3 | Na2SiO3 | 用来判定酸性:盐酸>碳酸>硅酸 |
D | 浓硫酸 | Cu | NaOH | 用来判定制备SO2并吸收尾气 |
A. A B. B C. C D. D