题目内容
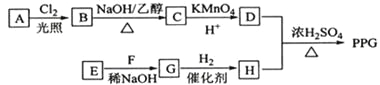
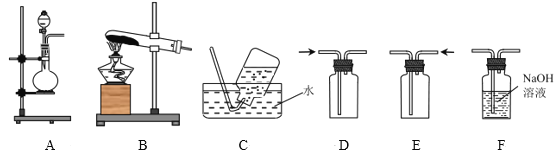
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
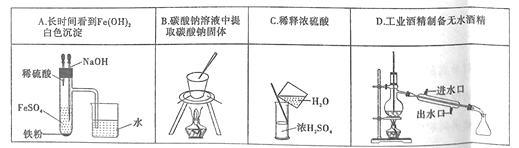
A.AB.BC.CD.D
【答案】A
【解析】
A.A中试管中还存在铁粉和稀硫酸,两者会发生反应产生氢气,将体系中的空气排除去,NaOH的滴管深入液面下与Fe2+反应生成Fe(OH)2白色沉淀,导管深入水面下,也是防止空气进入,所以可长时间看见Fe(OH)2白色沉淀,A正确;
B.碳酸钠溶液中提取碳酸钠固体时,要用蒸发皿而不是坩埚,B错误;
C.稀释浓硫酸时浓硫酸溶于水会放出大量的热,且水的密度比浓硫酸的密度小,如果将水倒入浓硫酸中,水会浮在浓硫酸的上面而沸腾造成液滴飞溅,所以稀释浓硫酸一定要将浓硫酸沿着容器壁慢慢倒入水中并不断搅拌使热量迅速散失,C错误;
D.工业酒精是乙醇和水的混合物,两者是共沸物,蒸馏时,气相和液相的组成是相同的,两者会同时蒸出,不能用蒸馏法制得无水酒精。制备无水酒精时,通常在工业酒精中加入生石灰,加热,使酒精中的水跟氧化钙反应,除去水分,然后再蒸馏,D错误;
答案选A。

【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__.
(2)表中元素原子半径最大的是(写元素符号)__.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为﹣69℃和58℃,写出该反应的热化学方程式:__.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为__,物质的量分别为__,生成硫酸铜物质的量为__.