题目内容
【题目】1000 ml某无色待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
现进行如下实验操作(所加试剂均过量):(已知:NH4+ + OH- (浓)= NH3↑ +H2O)
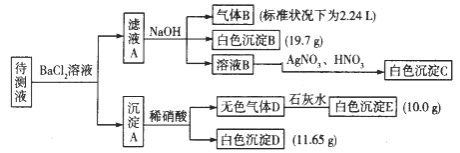
(1)原溶液中肯定存在的离子是(除Na+) ,肯定不存在的离子是 。
(2)写出生成白色沉淀B的离子方程式: 。写出沉淀A溶于稀硝酸的离子方程式:_____________________。
(3)将滤液A和沉淀A分开的操作是过滤,洗涤。洗涤的操作是 。
【答案】
(1)CO32-、HCO3-、SO42-K+、NH4+;Fe3+、Ba2+;
(2)HCO3-+OH-+Ba2+=BaCO3↓+H2O;BaCO3+2H+=Ba2++H2O+CO2↑;
(3)沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次。
【解析】
试题分析:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,不能确定原溶液中是否含有Cl-,若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定含有SO42-,B(碳酸钡)的物质的量=![]() =0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=
=0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=![]() =0.1mol/L, E(碳酸钙)的物质的量=
=0.1mol/L, E(碳酸钙)的物质的量=![]() =0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=
=0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=![]() =0.1mol/L,D(硫酸钡)的物质的量=
=0.1mol/L,D(硫酸钡)的物质的量=![]() =0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=
=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=![]() =0.05mol/L,n(NH4+)=n(NH3)=
=0.05mol/L,n(NH4+)=n(NH3)=![]() =0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,原溶液中肯定存在的离子有CO32-、HCO3-、SO42- K+、NH4+,肯定不存在的离子有Fe3+、Ba2+,故答案为:CO32-、HCO3-、SO42- K+、NH4+;Fe3+、Ba2+;
=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,原溶液中肯定存在的离子有CO32-、HCO3-、SO42- K+、NH4+,肯定不存在的离子有Fe3+、Ba2+,故答案为:CO32-、HCO3-、SO42- K+、NH4+;Fe3+、Ba2+;
(2)生成白色沉淀B的离子方程式为HCO3-+OH-+ Ba2+ = BaCO3↓+H2O,沉淀A溶于稀硝酸的离子方程式为BaCO3+2H+=Ba2+ +H2O+CO2↑,故答案为:HCO3-+OH-+ Ba2+ = BaCO3↓+H2O;BaCO3+2H+=Ba2+ +H2O+CO2↑;
(3)洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次,故答案为:沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次。

 作业辅导系列答案
作业辅导系列答案