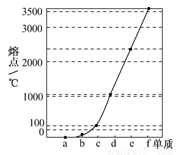
题目内容
A.碳是形成化合物最多的元素,其单质与化合物广泛分布于自然界.
(1)金刚石晶体中碳原子的杂化方式为
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为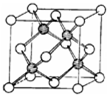 ;
;
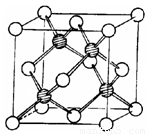
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,空心球和实心球表示相同的粒子,其中空心球位于立方体的顶点或面心,实心球位于立方体内)类似.每个冰晶胞平均占有
(1)金刚石晶体中碳原子的杂化方式为
sp3
sp3
.与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是N原子2p轨道半充满,能量低
N原子2p轨道半充满,能量低
;(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为
直线形
直线形
;写出二价铁离子的核外电子排布式1s22s22p63s23p63d6(或[Ar]3d6)
1s22s22p63s23p63d6(或[Ar]3d6)
 ;
;(3)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,空心球和实心球表示相同的粒子,其中空心球位于立方体的顶点或面心,实心球位于立方体内)类似.每个冰晶胞平均占有
8
8
个水分子,冰晶胞与金刚石晶胞微粒排列方式相似的原因是水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键
水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键
.分析:(1)根据价层电子对互斥理论确定其杂化类型,原子轨道中的电子处于全满、半满、全空时最稳定;
(2)根据价层电子对互斥理论确定其VSEPR模型,去掉孤电子对即是其实际空间构型,根据构造原理书写亚铁离子核外电子排布式;
(3)利用均摊法确定每个冰晶胞含有的水分子个数,根据氧原子和碳原子的杂化方式分析.
(2)根据价层电子对互斥理论确定其VSEPR模型,去掉孤电子对即是其实际空间构型,根据构造原理书写亚铁离子核外电子排布式;
(3)利用均摊法确定每个冰晶胞含有的水分子个数,根据氧原子和碳原子的杂化方式分析.
解答:解:(1)金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个 碳原子的价层电子对是4,则碳原子采取sp3杂化,N原子的核外电子排布式为:1s22s22p3,O原子核外电子排布式为1s22s22p4,2p轨道半充满的原子能量低,较稳定,所以与碳同周期的非金属元素N的第一电离能大于O的第一电离能,
故答案为:sp3;N原子2p轨道半充满,能量低;
(2)CS2分子中价电子对=2+
(4-2×2)=2,且没有孤电子对,所以是直线型分子,亚铁离子核外有24个电子,由铁原子失去2电子变成亚铁离子时,失去的电子是最外层电子,所以亚铁离子的核外电子排布式为1s22s22p63s23p63d6(或[Ar]3d6),
故答案为:直线形;1s22s22p63s23p63d6(或[Ar]3d6);
(3)每个冰晶胞平均占有分子个数=4+
×8+
×6=8,H2O的氧原子中含有2个σ键和2个孤电子对,金刚石中每个碳原子含有4个σ键且没有孤电子对,所以水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子形成2个原子,2个氢原子可以和另外2个水分子形成氢键,所以每个水分子可与相邻的4个水分子形成氢键,导致冰晶胞与金刚石晶胞微粒排列方式相似,
故答案为:8;水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键.
故答案为:sp3;N原子2p轨道半充满,能量低;
(2)CS2分子中价电子对=2+
| 1 |
| 2 |
故答案为:直线形;1s22s22p63s23p63d6(或[Ar]3d6);
(3)每个冰晶胞平均占有分子个数=4+
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:8;水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键.
点评:本题考查较综合,分子空间构型的判断、原子的杂化方式的判断、氢键等都是高考的热点,应注意这些方面知识的积累.

练习册系列答案
相关题目
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.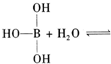

 。
。
 。
。