题目内容
【题目】(1)下面是4种粒子的结构示意图:
A.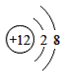 B.
B.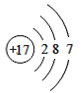 C.
C.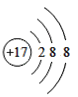 D.
D.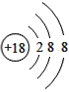
图中粒子共能表示______种元素,图中表示的阳离子是_______(用离子符号表示),图中C所表示的元素在元素周期表中的位置______。
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
C | D | ||||||||
A | B | E | F |
①D单质的电子式为:______;
②F的最高价氧化物对应水化物的化学式为:______;
③E和F分别形成的气态氢化物中稳定性较弱是______;(填写氢化物的化学式)
④A最高价氧化物的水化物所含化学键为_______,其水溶液与B的最高价氧化物的水化物反应的离子方程式为__。
【答案】3 Mg2+ 第三周期第ⅦA族 ![]() HClO4 H2S 离子键 共价键 Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O
HClO4 H2S 离子键 共价键 Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O
【解析】
(1)由四种粒子的结构示意图可知,核内的质子数有3种,则图中粒子表示3种元素;阳离子的核电荷数大于核外电子总数,四种粒子的结构示意图中,只有A的核内质子数(12)>核外电子数(10),表示的是阳离子,离子符号为Mg2+;C为Cl-,其原子序数=质子数=17,其原子结构示意图为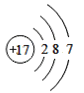 ,有三个电子层,最外层7个电子,则位于周期表中第三周期第 VIIA族;答案为:3,Mg2+,第三周期第 VIIA族。
,有三个电子层,最外层7个电子,则位于周期表中第三周期第 VIIA族;答案为:3,Mg2+,第三周期第 VIIA族。
(2)根据各元素的相对位置可知,A为Na元素、B为Al元素、C为C元素、D为N元素、E为S元素、F为Cl元素;
①D为N元素,其单质为N2,存在氮氮叁键,电子式为![]() ;答案为
;答案为![]() 。
。
②F为Cl元素,其最高正价为+7价,最高价氧化物对应水化物的化学式为HClO4;答案为HClO4。
③E为S元素、F为Cl元素,二者属于同周期元素,从左至右,非金属性增强,非金属性Cl>S,非金属性越强,对应氢化物的稳定性越强,则二者形成的气态氢化物中稳定性较弱的是H2S;答案为H2S。
④A为Na元素,其最高价氧化物的水化物为NaOH,其电子式为![]() ,则钠离子与氢氧根之间存在离子键,氢和氧之间存在共价键,B为Al元素,B的最高价氧化物的水化物为Al(OH)3,NaOH水溶液与Al(OH)3反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O;答案为离子键、共价键,Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O。
,则钠离子与氢氧根之间存在离子键,氢和氧之间存在共价键,B为Al元素,B的最高价氧化物的水化物为Al(OH)3,NaOH水溶液与Al(OH)3反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O;答案为离子键、共价键,Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O。

【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①、②两种元素的名称:______、______。
(2)写出⑧、⑨两种元素的符号______、______。
(3)在这些元素中,最活泼的金属元素的离子结构示意图是______最活泼的非金属元素是____(填元素符号,下同),______是最不活泼的元素。
(4)这些元素的最高价氧化物对应水化物中, _____(填化学式,下同)酸性最强, _____碱性最强;能形成两性氢氧化物的元素是______(填元素符号)。
(5)在⑤到![]() 的元素中, _____(填元素符号)原子半径最小。
的元素中, _____(填元素符号)原子半径最小。
(6)比较⑤和⑥的化学性质, _____(填元素符号)更活泼,试用实验证明之(简述操作、现象和结论)_____。