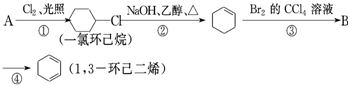
题目内容
在室温下pH=12的NaOH溶液100ml,要使它的pH变为11.
(1)①、如果加入蒸馏水,应加 mL②、如果加入pH=10的NaOH溶液,应加 mL③、如果加入0.01mol/L盐酸,应加 mL
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 (填序号),产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHCO3 e.CH3COONa
(3)25℃时,向纯水中加入Na2CO3,测得溶液的pH=10,则由水电离出的OH-离子浓度与溶液中的H+离子浓度之比为
(4)泡沫灭火器中的药品为Al2(SO4)3和小苏打溶液,使用时产生气体CO2.其反应的离子方程式: ;
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是 ;明矾可作净水剂,用有关的离子方程式解释 ,向明矾溶液中逐渐滴入Ba(OH)2溶液至SO42-离子恰好沉淀完全时,溶液的显 性(填酸、碱、中),离子反应的总方程式为: .
(6)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(7)醋酸电离方程式: ,把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是 .
(1)①、如果加入蒸馏水,应加
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHCO3 e.CH3COONa
(3)25℃时,向纯水中加入Na2CO3,测得溶液的pH=10,则由水电离出的OH-离子浓度与溶液中的H+离子浓度之比为
(4)泡沫灭火器中的药品为Al2(SO4)3和小苏打溶液,使用时产生气体CO2.其反应的离子方程式:
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是
(6)FeCl3的水溶液呈
(7)醋酸电离方程式:
考点:pH的简单计算,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)①先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;
②先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
③先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=
.
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;能形成原电池的装置能加快反应速率;
(3)根据氢离子浓度及水的离子积常数计算氢氧根离子浓度;
(4)从盐类的水解角度分析;
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性;因铝离子水解生成氢氧化铝胶体起净水作用;明矾晶体溶于水后的溶液中加入Ba(OH)2溶液,当溶液中的SO42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,以此来解答;
(6)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中;
(7)醋酸是弱电解质部分电离;加热蒸干并灼烧最终得到的是金属氧化物.
②先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
③先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=
| n(碱)-n(酸) |
| V(酸)+V(碱) |
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;能形成原电池的装置能加快反应速率;
(3)根据氢离子浓度及水的离子积常数计算氢氧根离子浓度;
(4)从盐类的水解角度分析;
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性;因铝离子水解生成氢氧化铝胶体起净水作用;明矾晶体溶于水后的溶液中加入Ba(OH)2溶液,当溶液中的SO42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,以此来解答;
(6)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中;
(7)醋酸是弱电解质部分电离;加热蒸干并灼烧最终得到的是金属氧化物.
解答:
解:(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=
=0.9L=900mL,
故答案为:900;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
③pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=
=
=0.001mol/L,
V=81.8mL,故答案为:81.8;
(2)水电离生成氢离子和氢氧根离子,所以酸能抑制水电离,锌和硫酸反应生成硫酸锌和氢气,硫酸锌是强酸弱碱盐,促进水电离,所以水的电离平衡向右移动;
a.向溶液中加入NaNO3,导致溶液中含有硝酸,硝酸和锌反应不产生氢气,故a错误;
b.CuSO4和锌发生置换反应生成铜,铜、锌和稀硫酸构成原电池,所以能加快反应速率,故b正确;
c.Na2SO4 不影响反应速率,故c错误;
d.NaHCO3和硫酸反应生成二氧化碳,氢离子浓度减小,所以生成氢气的速率减小,故d错误;
e.加入CH3COONa,醋酸是弱电解质,导致溶液中氢离子浓度减小,生成氢气速率减小,故e错误;
故答案为:向右;b;
(3)该溶液中氢离子浓度为10-10,mol/L,则溶液中氢氧根离子浓度=
mol/L=10-4mol/L,所以由水电离出的OH-离子浓度与溶液中的H+离子浓度之比为106:1,故答案为:106:1;
(4)HCO3-水解,反应为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;Al3+水解,反应为:Al3++3H2O?Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,故答案为:3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性,所以离子浓度大小顺序为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);因铝离子水解生成氢氧化铝胶体起净水作用,水解离子反应为Al3++3H2O?Al(OH)3(胶体)+3H+;
明矾晶体溶于水后的溶液中加入Ba(OH)2溶液,当溶液中的SO42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,该离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,
故答案为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);Al3++3H2O?Al(OH)3(胶体)+3H+;碱;Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O;
(6)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+3H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+3H+;抑制;
(7)醋酸是弱电解质部分电离,电离方程式为:CH3COOH?CH3COO-+H+;AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:CH3COOH?CH3COO-+H+;Al2O3.
| 0.01mol/L×0.1L |
| 0.001mol/L |
故答案为:900;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
③pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=
| n(碱)-n(酸) |
| V(酸)+V(碱) |
| 0.01mol/L×(0.1-V)L |
| (0.1+V)L |
V=81.8mL,故答案为:81.8;
(2)水电离生成氢离子和氢氧根离子,所以酸能抑制水电离,锌和硫酸反应生成硫酸锌和氢气,硫酸锌是强酸弱碱盐,促进水电离,所以水的电离平衡向右移动;
a.向溶液中加入NaNO3,导致溶液中含有硝酸,硝酸和锌反应不产生氢气,故a错误;
b.CuSO4和锌发生置换反应生成铜,铜、锌和稀硫酸构成原电池,所以能加快反应速率,故b正确;
c.Na2SO4 不影响反应速率,故c错误;
d.NaHCO3和硫酸反应生成二氧化碳,氢离子浓度减小,所以生成氢气的速率减小,故d错误;
e.加入CH3COONa,醋酸是弱电解质,导致溶液中氢离子浓度减小,生成氢气速率减小,故e错误;
故答案为:向右;b;
(3)该溶液中氢离子浓度为10-10,mol/L,则溶液中氢氧根离子浓度=
| 10-14 |
| 10-10 |
(4)HCO3-水解,反应为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;Al3+水解,反应为:Al3++3H2O?Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,故答案为:3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(5)明矾是KAl(SO4)2?12H2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性,所以离子浓度大小顺序为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);因铝离子水解生成氢氧化铝胶体起净水作用,水解离子反应为Al3++3H2O?Al(OH)3(胶体)+3H+;
明矾晶体溶于水后的溶液中加入Ba(OH)2溶液,当溶液中的SO42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,该离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,
故答案为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);Al3++3H2O?Al(OH)3(胶体)+3H+;碱;Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O;
(6)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+3H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+3H+;抑制;
(7)醋酸是弱电解质部分电离,电离方程式为:CH3COOH?CH3COO-+H+;AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:CH3COOH?CH3COO-+H+;Al2O3.
点评:本题考查了弱电解质电离及酸碱混合溶液定性判断等知识点,明确弱电解质电离特点是解本题关键,注意(2)中硝酸和锌反应不产生氢气,为易错点.

练习册系列答案
相关题目
下列四种工业生产:①用海水为原料制镁;②冶炼生铁;③制漂白粉;④从海带中提取碘.要用石灰石作为一种原料的( )
| A、只有① | B、只有①②③ |
| C、只有②③ | D、全部 |
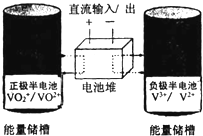 全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A、放电时,右槽发生还原反应 |
| B、放电时,左槽电解液pH升高 |
| C、充电时,阴极的电极反应式:VO2++2H++e-═VO++H2O |
| D、充电时,每转移1mol电子,n(H+)的变化量为1mol |
进行下列实验操作时,一般情况下不应该相互接触的是( )
| A、用移液管移取10mL NaOH溶液并放于锥形瓶中,移液管的尖嘴和锥形瓶的内壁 |
| B、减压过滤时,布氏漏斗下端管口与吸滤瓶的内壁 |
| C、实验室将HCl气体溶于水时,倒扣的三角漏斗口与烧杯内的水面 |
| D、分液操作分出下层液体时,分液漏斗下端管口和烧杯的内壁 |
用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的种类数为( )
| A、3 | B、6 | C、5 | D、4 |
 和
和 :
: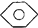 ,
, 和C6H12(已烯):
和C6H12(已烯):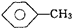 ,CCl4和乙醇
,CCl4和乙醇 的系统命名:
的系统命名: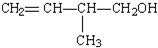 的键线式:
的键线式: