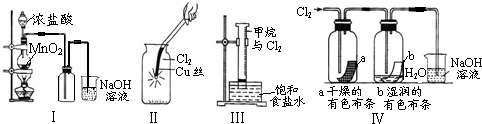
题目内容
某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
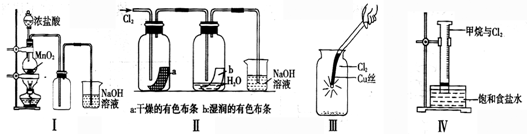

分析:A、从浓盐酸随着反应进行浓度减小后不与二氧化锰继续反应分析判断;
B、依据起漂白作用的是次氯酸,结合氯气与水反应生成的氯化钠和次氯酸钠在酸性溶液中会发生归中反应分析错误;
C、铜在氯气中燃烧产生棕色的烟分析;
D、依据甲烷和氯气反应的实质是取代反应分析判断.
B、依据起漂白作用的是次氯酸,结合氯气与水反应生成的氯化钠和次氯酸钠在酸性溶液中会发生归中反应分析错误;
C、铜在氯气中燃烧产生棕色的烟分析;
D、依据甲烷和氯气反应的实质是取代反应分析判断.
解答:解:A、Ⅰ图中:如果MnO2过量,浓盐酸随着反应进行,浓度减小到一定程度,不再与二氧化锰继续反应,所以盐酸不能全部消耗,故A错误;
B、Ⅱ图中:湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+H+=Cl2↑+H2O,所以结果有Cl2生成,故B正确;
C、Ⅲ图中:铜在氯气中燃烧产生棕色的烟,故C错误;
D、甲烷和氯气在光照条件下发生取代反应,特征是有出有进,故D错误;
故选B.
B、Ⅱ图中:湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+H+=Cl2↑+H2O,所以结果有Cl2生成,故B正确;
C、Ⅲ图中:铜在氯气中燃烧产生棕色的烟,故C错误;
D、甲烷和氯气在光照条件下发生取代反应,特征是有出有进,故D错误;
故选B.
点评:本题考查了实验基本操作的装置、现象、原理,主要是物质化学性质的具体应用,关键是明确氯化钠和次氯酸钠在酸溶液中的氧化还原反应.

练习册系列答案
相关题目
某同学用下列装置制备并检验Cl2的性质.下列说法错误的是( )
A、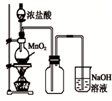 如图中:即使MnO2过量,盐酸也不能全部消耗 | B、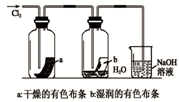 如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 | C、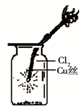 如图中:生成棕色的烟 | D、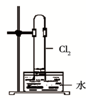 如图中:水可以充满试管 |
某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A、实验室制氯气中除去尾气用澄清石灰水 | B、吸收了氯气的NaOH溶液中滴入硫酸,至溶液显酸性,结果有Cl2生成 | C、铜丝在氯气中燃烧生成蓝色的烟 | D、甲烷和氯气的混合气体中发生了加成反应 |