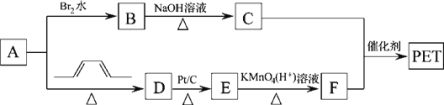
题目内容
【题目】25![]() C时,水的电离平衡:H2O
C时,水的电离平衡:H2O![]() H++OH-
H++OH-![]() H>0,下列叙述正确的是
H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D.将水加热,Kw增大,c(H+)不变
【答案】B
【解析】
水电离是吸热反应,
A、向水中加入稀氨水,即加入碱,平衡逆向移动,c(OH-)增大,A项错误;
B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变,Kw只受温度影响,B项正确;
C、向水中加入少量固体NaOH,即加入碱,平衡逆向移动,c(OH-)增大,C项错误;
D、将水加热,Kw增大,电离平衡正向移动,c(H+)增大,D项错误;
答案选B。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___、___。
(2)取10.00mL待测液,用___滴定管量取。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定到终点。
(4)根据下列数据,c(NaOH)=___,烧碱的纯度为___。
滴定次数 | 待测液体积 (mL) | 标准盐酸的体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填偏大、偏小、无影响)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③用待测液润洗锥形瓶___。
④不小心将标准液滴在锥形瓶外面___。
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁___。
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
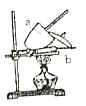
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。