题目内容
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
A.将11.2gFe粉投入到足量稀硫酸中,在标准状况下生成的气体分子数为0.3NA
B.500mL 0.2mol·L-1 CaCl2溶液中,Ca2+和Cl-离子总数为0.2NA
C.标准状况下,22.4 L SO3含有的分子数为NA
D.常温常压下,32 g O2和32 g O3含有的氧原子数均为2NA
【答案】D
【解析】
A.11.2g铁的物质的量为0.2mol,而1mol铁和H+反应时,生成1mol氢气,故0.2mol铁生成的氢气分子为0.2NA个,故A错误;
B. 500mL 0.2mol·L-1 CaCl2溶液中,Ca2+和Cl-离子总数为(0.2+0.4)mol/L×0.5L×NA=0.3NA,故B错误;
C.标准状况下,SO3为固体,故C错误;
D.常温常压下,32 g O2和32 g O3含有的氧原子数均为![]() =2NA,故D正确;
=2NA,故D正确;
答案:D

【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学用到的玻璃仪器除了烧杯、量筒、试剂瓶,还需要_________________。
(2)其操作步骤如下图所示,则如图操作应在下图中的_______(填选项字母)之间。
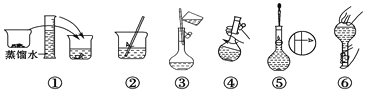
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母)
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项________(填字母)。
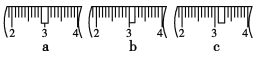
(4)下列操作对所配溶液的浓度大小有何影响?
① 转移完溶液后未洗涤玻璃棒和烧杯,浓度会_______(填“偏大”、“偏小”或“无影响”,下同)。
② 容量瓶中原来有少量蒸馏水,浓度会__________。
③ 以480mL溶液体积计算所需NaOH的质量_________。
④ 未冷却到室温就注入容量瓶定容_________。