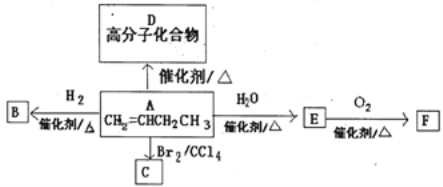
题目内容
【题目】某同学通过如下流程制备氧化亚铜:
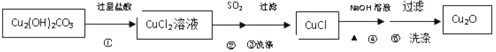
已知:![]() 难溶于水和稀硫酸;
难溶于水和稀硫酸;![]()
下列说法错误的是
A.步骤②中的![]() 可用
可用![]() 替换
替换
B.在步骤③中为防止![]() 被氧化,可用
被氧化,可用![]() 水溶液洗涤
水溶液洗涤
C.步骤④发生反应的离子方程式为:![]()
D.如果![]() 试样中混有
试样中混有![]() 和
和![]() 杂质,用足量稀硫酸与
杂质,用足量稀硫酸与![]() 试样充分反应,根据反应前、后固体质量可计算试样纯度
试样充分反应,根据反应前、后固体质量可计算试样纯度
【答案】D
【解析】
碱式碳酸铜溶于过量的稀盐酸,得到CuCl2溶液,向此溶液中通入SO2,利用SO2的还原性将Cu2+还原生成CuCl白色沉淀,将过滤后的CuCl与NaOH溶液混合加热得砖红色沉淀Cu2O,据此解答。
A.Na2SO3有还原性,则步骤②还原Cu2+,可用Na2SO3替换SO2,故A正确;
B.CuCl易被空气中的氧气氧化,用还原性的SO2的水溶液洗涤,可达防氧化的目的,故B正确;
C.CuCl与NaOH溶液混合加热得砖红色沉淀Cu2O,根据电子守恒、电荷守恒及原子守恒可知发生反应的离子方程式为2CuCl+2OH-![]() Cu2O+2Cl-+H2O,故C正确;
Cu2O+2Cl-+H2O,故C正确;
D.CuCl也不溶于水和稀硫酸,Cu2O溶于稀硫酸生成不溶于的Cu,则过滤后所得滤渣为Cu和CuCl的混合物,无法计算出样品中Cu2O的质量,即无法计算样品纯度,故D错误;
故选D。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ④ | ⑥ | ||||||
3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(1)在①~⑧元素中化学性质最不活泼的元素的名称是____,金属性最强的元素的名称是____。
(2)③、④、⑥三种元素中的原子半径最小的是_____________(填元素符号)。
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是____(用离子符号填写)。
(4)④与⑥形成的化合物的电子式为_____________。
(5)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:____。