题目内容
【题目】甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应∶
反应①∶CH3OH(g)==CO(g)+2H2(g) △H1
反应②∶CO(g) + H2O(g)==CO2(g)+H2(g) △H2
根据能量变化示意图,下列说法不正确的是( )
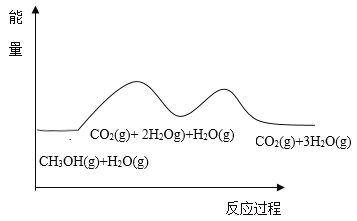
A.总反应的热化学方程式为∶ CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ![]()
B.1mol CO(g)和1mol H2O(g)的总键能大于lmol CO2(g)和1mol H2(g)的总键能
C.甲醇与水蒸气催化重整的总反应速率取决于反应①
D.催化剂在反应中改变了活化能,加快了反应速率
【答案】B
【解析】
A.根据盖斯定律,由①+②得总反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ![]() ,选项A正确;
,选项A正确;
B. 由图中信息可知反应②∶CO(g) + H2O(g)==CO2(g)+H2(g) △H2<0,故1mol CO(g)和1mol H2O(g)的总键能小于lmol CO2(g)和1mol H2(g)的总键能,选项B不正确;
C. 反应①的活化能较高,故甲醇与水蒸气催化重整的总反应速率取决于反应①,选项C正确;
D. 催化剂在反应中改变了活化能,使反应物的活化能降低,加快了反应速率,选项D正确;
答案选B。

练习册系列答案
相关题目