题目内容
【题目】
已知下列两个反应:
①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
试回答下列问题:
(1)反应①中________(填元素符号)被氧化,还原产物为________;反应②中________作还原剂,________元素被还原。
(2)当反应①生成2gH2时,消耗H2SO4的质量是________g。
(3)反应②中生成32gSO2气体时,消耗H2SO4的质量是________g,其中有________gH2SO4被还原,转移电子________mol。
【答案】
(1)FeH2CuS
(2)98
(3)98491
【解析】
试题分析:(1)反应①中Fe元素化合价升高被氧化,发生氧化反应,对应FeSO4为氧化产物,H2SO4中氢元素化合价降低,被还原,发生还原反应,对应H2为还原产物。反应②中铜元素化合价升高,作还原剂,硫酸中S元素化合价降低被还原。
(2)反应①当有2gH2生成时,消耗H2SO4的质量m(H2SO4)=n(H2SO4)×98g·mol-1=n(H2)×98g·mol-1=![]() ×98g·mol-1=98g;
×98g·mol-1=98g;
(3)反应②中,生成的n(SO2)=![]() =0.5mol,则
=0.5mol,则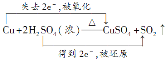 +2H2O,当生成0.5molSO2时,反应掉浓H2SO4的物质的量为1mol,质量为98g;转移1mole-,其中有49gH2SO4被还原。
+2H2O,当生成0.5molSO2时,反应掉浓H2SO4的物质的量为1mol,质量为98g;转移1mole-,其中有49gH2SO4被还原。

练习册系列答案
相关题目


