题目内容
下列叙述正确的是
| A.非金属元素形成的离子一定是阴离子 |
| B.非金属单质在氧化还原反应中一定是氧化剂 |
| C.某元素从化合态变为游离态时,一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
D
解析试题分析:A.非金属元素形成的离子可以是阳离子如NH4+,也可以是阴离子如CO32-等。错误。B.如在反应Cl2+H2O HCl+HClO中Cl2既是氧化剂又是还原剂。错误。C.某元素从化合态变为游离态时,可能是被还原如在H2+CuO
HCl+HClO中Cl2既是氧化剂又是还原剂。错误。C.某元素从化合态变为游离态时,可能是被还原如在H2+CuO Cu+H2O的Cu元素,也可能是被氧化,如在Cl2+2KI=2KCl+I2的I元素。错误。D.金属阳离子被还原可能得到金属单质H2+CuO
Cu+H2O的Cu元素,也可能是被氧化,如在Cl2+2KI=2KCl+I2的I元素。错误。D.金属阳离子被还原可能得到金属单质H2+CuO Cu+H2O,也可能得到金属化合物。如2FeCl3+Zn=2FeCl2+ZnCl2.正确。
Cu+H2O,也可能得到金属化合物。如2FeCl3+Zn=2FeCl2+ZnCl2.正确。
考点:考查氧化还原反应中的一些理论的知识。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案工业上粗硅的生产原理为2C+SiO2 Si+2CO↑,下列说法正确的是
Si+2CO↑,下列说法正确的是
| A.SiO2是氧化剂 | B.SiO2发生氧化反应 |
| C.C表现出氧化性 | D.C被还原 |
用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物
中的化合价是
| A.+4 | B.+3 | C.+2 | D.+1 |
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
| A.100mL | B.160mL | C.240mL | D.307mL |
去年下半年我省雾霾天气十分严重。PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO—催化剂→N2+CO2,下列关于此反应的说法中,不正确的是
| A.所涉及元素的第一电离能:N>O>C |
| B.当x=2时,每生成1molN2,转移电子数为4mol |
C.等物质的量N2和CO2中,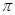 键的个数比为1:1 键的个数比为1:1 |
| D.氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )。
| A.1∶6 | B.16∶25 | C.2∶11 | D.1∶7 |
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个AlO2-,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为( )
A.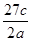 | B.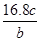 | C.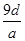 | D.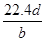 |
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1Na2S2O3溶液恰
好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O42—将转化为( )
| A.S2- | B.S | C.SO32— | D.SO42— |
根据以下实验事实,判断选项中四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
(1)向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色;
(2)向FeCl2溶液中加入氯水,再加入KSCN溶液,溶液呈红色;
(3)向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
| A.I2>Cl2>Fe3+>MnO4- |
| B.MnO4->Cl2>Fe3+>I2 |
| C.Cl2>I2>Fe3+,MnO4->Fe3+ |
| D.Fe3+>MnO4->Cl2>I2 |