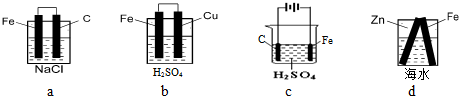
题目内容
(2013?浦东新区二模)用下列实验装置进行的实验中,能达到相应实验目的是( )

分析:A.根据U形管内液体的液面变化可判断反应是吸热反应还是放热反应;
B.乙烯和乙炔都含有不饱和键,都能与酸性高锰酸钾溶液反应;
C.实验室制硝基苯温度应在50~60℃;
D.反应2NO2(g)?N2O4(g)是吸热反应.
B.乙烯和乙炔都含有不饱和键,都能与酸性高锰酸钾溶液反应;
C.实验室制硝基苯温度应在50~60℃;
D.反应2NO2(g)?N2O4(g)是吸热反应.
解答:解:A.钠和水的反应为放热反应,反应后试管内温度升高,压强增大,U形管左端液面下降,故A正确;
B.乙烯和乙炔都含有不饱和键,都能与酸性高锰酸钾溶液反应,故B错误;
C.硝酸加热易分解,苯易挥发,则实验室制硝基苯温度应在50~60℃,否则会导致产量降低,故C正确;
D.放在冷水中的颜色加深,说明降低温度向放热方向进行,生成较多二氧化氮,则说明2NO2(g)?N2O4(g)是吸热反应,故D错误.
故选AC.
B.乙烯和乙炔都含有不饱和键,都能与酸性高锰酸钾溶液反应,故B错误;
C.硝酸加热易分解,苯易挥发,则实验室制硝基苯温度应在50~60℃,否则会导致产量降低,故C正确;
D.放在冷水中的颜色加深,说明降低温度向放热方向进行,生成较多二氧化氮,则说明2NO2(g)?N2O4(g)是吸热反应,故D错误.
故选AC.
点评:本题考查较为综合,侧重于物质性质实验方案的设计和实验方案的评价,注意把握物质的性质,易错点为D,注意根据实验现象判断反应热.

练习册系列答案
相关题目