题目内容
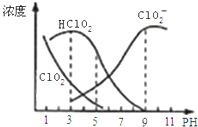
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
【答案】C
【解析】
A、1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,根据盐类越弱越水解的原理分析;
B、据图象分析,pH=13时仍有HCO3-;
C、![]() 为HCO3-的电离平衡常数表达式,其大小只受温度影响;
为HCO3-的电离平衡常数表达式,其大小只受温度影响;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳。
A、根据越弱越水解原理,1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3H2O)>Ka(H2CO3)>Ka2(H2CO3),选项A错误;
B、只要存在碳酸氢根离子就存在HC03-的水解平衡,选项B错误;
C、温度不变,碳酸氢根离子的电离平衡常数不变,选项C正确;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),选项D错误;
答案选C。

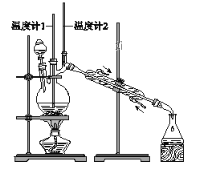
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物