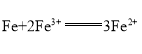题目内容
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
【答案】D
【解析】
A、能自发进行的过程必须符合:△H-T△S<0,熵值增大不是唯一的判据,A错误;
B、2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),该反应为可逆反应,2 mol SO2(g)和1 mol O2(g)反应不能完全进行,所以放出的热量小于Q kJ,B错误;
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),该反应为可逆反应,2 mol SO2(g)和1 mol O2(g)反应不能完全进行,所以放出的热量小于Q kJ,B错误;
C、化学平衡常数只受温度的影响,温度不变,平衡常数不变,C错误;
D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,醋酸是弱酸,电离需要吸收热量,所以后者比前者放出的热量多,D正确;
答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目