题目内容
已知KH和H2O反应生成H2和KOH,反应中1 molKH( )A.失去1 mol电子 B.得到1 mol电子 C.失去2 mol电子 D.没有电子得失
解析:本题考查氧化还原反应中电子转移的有关知识。KH与H2O反应时的电子转移情况为
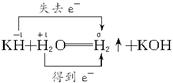 ,所以反应中1 mol KH失去1 mol电子。
,所以反应中1 mol KH失去1 mol电子。
氧化还原反应最重要的规律就是电子得失守恒,氧化剂得到的电子总数等于还原剂失去的电子总数。表现在氧化还原反应中就是元素化合价的升降总数相等,且元素化合价升降总数=(高价-低价)×变价原子数。
答案:A

练习册系列答案
相关题目
已知KH和H2O反应方程式为 KH+H2O=H2+KOH,反应中1mol KH( )
| A、没有电子得失 | B、得到1mol电子 | C、失去2mol电子 | D、失去1mol电子 |
已知KH和H2O反应生成H2和KOH,反应中1mol KH( )
| A、失去1mol电子 | B、得到1mol电子 | C、失去2mol电子 | D、没有电子得失 |
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。