题目内容
下列有关判断正确的是( )
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
| B.能使紫色石蕊试液呈红色的溶液:Na+、NH、I-、NO可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
A
解析试题分析:A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+)符合质子守恒。正确。B.能使紫色石蕊试液呈红色的溶液是酸性溶液。此时会发生反应:8H++6I-+2NO=3I2+2NO↑+ 4H2O不能大量共存。错误。C.在室温下 pH=13的氢氧化钠溶液中:c(OH-)=Kw÷c(H+)=10-14÷10-13=0.1mol/L.水的电量是吸热过程。若是升高温度,则促进水的电离,Kw增大。c(OH-)>0.1mol/L。错误。D.NH4HCO3溶于过量的NaOH溶液中发生反应:HCO3-+ NH4++ 2OH-= CO32- + 2H2O+NH3↑。错误。
考点:考查离子浓度的关系、离子方程式的正误判断、离子的共存及水的电离的知识。

 考前必练系列答案
考前必练系列答案向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4+ + SO42—+ Ba2+ +OH— BaSO4↓+ NH3·H2O BaSO4↓+ NH3·H2O |
B.2Al3+ + 3SO42—+3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓ 3BaSO4↓+ 2Al(OH)3↓ |
C.Al3+ + 2SO42—+ 2Ba2+ + 4OH— 2BaSO4↓+ AlO2—+ 2H2O 2BaSO4↓+ AlO2—+ 2H2O |
D.NH4++Al3+ +2SO42—+2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O 2BaSO4↓+ Al(OH)3↓+ NH3·H2O |
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
| A.K+、Ca2+、Br-、Cl- | B.NH3·H2O、SO32-、K+、Na+ |
| C.Fe2+、Na+、K+、NO3- | D.Na+、Mg2+、Cl-、ClO- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
下列离子方程式书写正确的是( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO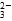 +H2O +H2O |
| B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO +5NO +5NO +6H+=2Mn2++5NO +6H+=2Mn2++5NO +3H2O +3H2O |
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO +Ba2++2OH-=BaCO3↓+2H2O+CO +Ba2++2OH-=BaCO3↓+2H2O+CO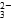 |
在下述条件下,一定能大量共存的离子组是( )。
| A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4- |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br- |
| D.强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )。
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
| A.①③ | B.①②③ | C.①③④ | D.②③④ |
某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、CO32-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )。
| A.K+ | B.SO42- | C.Ba2+ | D.NH4+ |
向含有等物质的量的NH4+、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,
并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
| A.H++OH-=H2O |
| B.Al3++3OH-=Al(OH)3↓ |
| C.Al(OH)3+OH-=AlO2-+2H2O |
| D.NH4++OH-=NH3·H2O |