题目内容
已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ?H=-48.40kJ/mol |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-5518kJ/mol |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=+5518kJ/mol |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-48.40kJ/mol |
B
解析试题分析:首先写出化学方程式并注明各物质的状态,特别是H2O为液态,然后由lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,求出1molC8H18燃烧生成二氧化碳和液态水放出的热量:48.4kJ×114=5518kJ,即?H=-5518kJ?mol?1,故B项正确。
考点:本题考查热化学方程式的书写。

下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
| A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol |
| D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol |
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+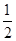 N2O4(g)= N2O4(g)=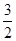 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1 |
形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
| A.研究采煤、采油新技术,提高产量以满足工业生产的快速发展 |
| B.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 |
| C.在农村推广使用沼气 |
| D.减少资源消耗、增加资源的重复使用和资源的循环再生 |
已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
下列变化过程,属于放热过程的是
| A.液态水变成水蒸气 | B.酸碱中和反应 |
| C.弱酸电离 | D.NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 |
某废水处理厂处理废水中NH+的过程如下:
①NH4+(aq)+ O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
②2HNO2(aq)+O2(g)=2NO3-(aq)+2H+ ΔH=-aKJ/mol
下列叙述正确的是( )
| A.将NH4+转化为NO3-的热化学方程式可表示为: NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)ΔH=-(b+  )KJ/mol )KJ/mol |
| B.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
| C.常温下,若HNO3溶液中c(H+)="0.1" mol·L-1,则该溶液的pH>1 |
| D.若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |