题目内容
Al和Al2O3的混合物15g,加入稀H2SO4150mL,在标准状况下放出氢气1.68L,Al和Al2O3均不剩余,为中和过量的硫酸,并使溶液中Al3+恰好完全转化为Al(OH)3沉淀,需要消耗3mol·L-1NaOH溶液200mL,则该稀硫酸的物质的量浓度为( )
| A.2.25 mol·L-1 | B.2 mol·L-1 | C.0.3 mol·L-1 | D.0.6 mol·L-1 |
B
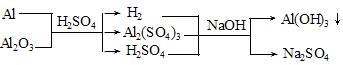
根据最终溶液中的电荷守恒和化学反应中的质量守恒可得:
n(H2SO4)=n(Na2SO4)=
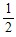 n(NaOH)=
n(NaOH)=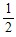 ×3mol·
×3mol·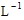 ×0.2L=0.3 mol
×0.2L=0.3 mol所以c(H2SO4)=
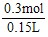 =2 mol·L-1。
=2 mol·L-1。
练习册系列答案
相关题目
