题目内容
将200mL稀硝酸与足量的铜粉在微热的条件下发生反应,经测定,生成了1.12LNO(标准状况)。试计算
(1)参加反应的铜的质量;
(2)该硝酸溶液中HNO3的物质的的量浓度;
【答案】
(1) 4.48 (2)1.0
【解析】
试题分析:生成的NO是1.12L÷22.4L/mol=0.05mol
所以根据电子的得失守恒可知,消耗铜的质量是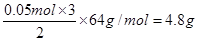
生成硝酸铜的物质的量是0.075mol,则没有被还原的硝酸是0.075mol×2=0.15mol
被还原的硝酸是0.05mol
所以参加反应的硝酸是0.15mol+0.05mol=0.2mol
则硝酸的浓度是0.2mol÷0.2L=1.0mol/L。
考点:考查硝酸与铜反应的有关计算
点评:该题是基础性试题的考查,难度不大。主要是有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好几种守恒法,即质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目