题目内容
将200mL稀硝酸与6.4g的铜粉在微热的条件下充分反应,还原产物为NO,经测定NO的体积为1.12L(标准状况).
(1)写出铜与稀硝酸反应的离子方程式:______
(2)求出该硝酸溶液中HNO3的物质的量浓度及参加反应的铜的质量;
(3)现用12.5mol?L-1的浓硝酸来配制500mL该稀硝酸.可供选择的仪器有:
①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙.上述仪器中,配制时不需要使用的仪器有______(填代号),还缺少的一种仪器是______.
解:(1)由Cu与稀硝酸反应生成硝酸铜、NO和水,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)NO的物质的量为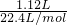 =0.05mol,设铜的物质的量为x,
=0.05mol,设铜的物质的量为x,
由电子守恒可知,0.05mol×(5-2)=x×(2-0),
解得x=0.075mol,
Cu的质量为0.075mol×64g/mol=4.8g,
由氮原子守恒可知,硝酸的物质的量为0.075mol×2+0.05mol=0.2mol,
硝酸溶液中HNO3的物质的量浓度为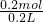 =1mol/L,
=1mol/L,
答:该硝酸溶液中HNO3的物质的量浓度为1mol/L及参加反应的铜的质量为4.8g;
(3)浓溶液的配制稀溶液需要烧杯、玻璃棒、胶头滴管、量筒、容量瓶,故不需要②⑥⑦,
又配制500mL该稀硝酸,需要500mL容量瓶,故答案为:②⑥⑦;500mL容量瓶.
分析:(1)Cu与稀硝酸反应生成硝酸铜、NO和水;
(2)利用气体NO的物质的量和电子守恒先计算Cu的物质的量,再利用氮原子守恒来计算硝酸的物质的量;
(3)浓溶液的配制稀溶液需要烧杯、玻璃棒、胶头滴管、量筒、容量瓶.
点评:本题考查硝酸的性质及溶液的配制,明确硝酸与铜的反应、硝酸的作用、溶液的配制步骤是解答的关键,并学会利用电子守恒、原子守恒等来解答.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)NO的物质的量为
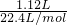 =0.05mol,设铜的物质的量为x,
=0.05mol,设铜的物质的量为x,由电子守恒可知,0.05mol×(5-2)=x×(2-0),
解得x=0.075mol,
Cu的质量为0.075mol×64g/mol=4.8g,
由氮原子守恒可知,硝酸的物质的量为0.075mol×2+0.05mol=0.2mol,
硝酸溶液中HNO3的物质的量浓度为
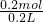 =1mol/L,
=1mol/L,答:该硝酸溶液中HNO3的物质的量浓度为1mol/L及参加反应的铜的质量为4.8g;
(3)浓溶液的配制稀溶液需要烧杯、玻璃棒、胶头滴管、量筒、容量瓶,故不需要②⑥⑦,
又配制500mL该稀硝酸,需要500mL容量瓶,故答案为:②⑥⑦;500mL容量瓶.
分析:(1)Cu与稀硝酸反应生成硝酸铜、NO和水;
(2)利用气体NO的物质的量和电子守恒先计算Cu的物质的量,再利用氮原子守恒来计算硝酸的物质的量;
(3)浓溶液的配制稀溶液需要烧杯、玻璃棒、胶头滴管、量筒、容量瓶.
点评:本题考查硝酸的性质及溶液的配制,明确硝酸与铜的反应、硝酸的作用、溶液的配制步骤是解答的关键,并学会利用电子守恒、原子守恒等来解答.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目