题目内容
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g) (△H>0)的平衡常数K=
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:下列判断有错的是( )
| △ |
| 9 |
| 4 |
| 起始浓度(mol/L) | 甲 | 乙 | 丙 | 丁 |
| c(H2) | 0.01 | 0.02 | 0.02 | 0.005 |
| c(CO2) | 0.01 | 0.01 | 0.02 | 0.005 |
| c(H2O) | 0 | 0 | 0 | 0.005 |
| c(CO) | 0 | 0 | 0 | 0.005 |
| A、平衡时,乙中CO2的转化率>60% | ||
B、平衡时,四容器中甲的
| ||
| C、起始时丁向正反应方向进行 | ||
| D、反应开始时,丙中反应速率最快 |
分析:物质的浓度越大,化学反应速率越快;增大一种反应物的浓度可以提高另一反应物的转化率;平衡常数只与温度有关.
解答:解:设甲中CO2的转化率为x,则
H2(g)+CO2(g)?H2O(g)+CO(g)
始 0.01 0.01 0 0
终 0.01(1-x) 0.01(1-x) 0.01x 0.01x
K=
=
,解得x=0.6,故甲中CO2的转化率为60%;
A.乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,会大于甲中的,即大于60%,故A正确;
B.平衡常数只受温度的影响,温度一定,平衡常数保持不变,故B错误;
C.起始时丁中
=
=1<
,故反应向正反应方向进行,故C正确;
D.反应开始时,丙中的物质的浓度最大,反应速率最快,故D正确;
故选B.
H2(g)+CO2(g)?H2O(g)+CO(g)
始 0.01 0.01 0 0
终 0.01(1-x) 0.01(1-x) 0.01x 0.01x
K=
| 0.01x×0.01x |
| 0.01(1-x)×0.01(1-x) |
| 9 |
| 4 |
A.乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,会大于甲中的,即大于60%,故A正确;
B.平衡常数只受温度的影响,温度一定,平衡常数保持不变,故B错误;
C.起始时丁中
| c(H2O)?c(CO) |
| c( H2)?c(CO2) |
| 0.005?0.005 |
| 0.005?0.005 |
| 9 |
| 4 |
D.反应开始时,丙中的物质的浓度最大,反应速率最快,故D正确;
故选B.
点评:本题主要考查温度对化学平衡常数的影响以及影响化学反应速率的因素,难度中等.要注意平衡常数只与温度有关.

练习册系列答案
相关题目
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K= H2O(g)+CO(g)的平衡常数K=
|
 H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数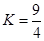 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )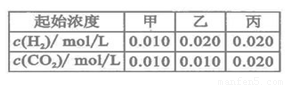
 某温度下,H2(g)+CO2(g)
某温度下,H2(g)+CO2(g)
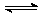 H2O(g)+CO(g)的平衡常数
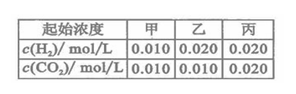
H2O(g)+CO(g)的平衡常数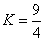 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是