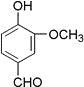
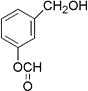
题目内容
【题目】在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
(1)阴极发生______ 反应,电极反应为________________。
(2)阳极电极反应为_____________________________ 。
(3)电解后得到的Cu的质量是________ ,得到O2的体积(标准状况)是________ 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差____ ,电解液的pH________ (填“变小”、“变大”或“不变”)
【答案】还原反应 2Cu2+ + 4e- = 2Cu 4OH- - 4e- = 2H2O + O2↑ 6.4g 1.12L 12.8g 不变
【解析】
(1)根据得失电子判断反应类型;根据离子放电顺序书写阴极电极反应式;
(2)根据离子放电顺序书写阳极电极反应式;
(3)根据铜、氧气与转移电子的关系计算铜的质量、氧气的体积;
(4)根据溶解的铜、析出的铜与电子的关系计算,然后两数值相加即得电解后两铜片的质量差。
(1)阴极上得电子,发生还原反应;阴极上铜离子的放电能力大于氢离子的放电能力,所以阴极上析出铜,故电极反应式为Cu2++2e-═Cu;
(2)阳极上氢氧根离子失电子生成氧气,电极反应式为4OH- - 4e- = 2H2O + O2↑;
(3)2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2×64g 4mol
6.4g 0.2mol
所以铜的质量为6.4g;
2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
22.4L 4mol
1.12 L 0.2mol
所以生成氧气的体积为1.12 L;
(4)当以铜片作电极时,阳极上铜失电子变成离子进入溶液,所以铜片质量减少;阴极上铜离子得电子生成铜单质,铜片质量增加,
两极的质量差=阳极上减少的质量+阴极上增加的质量.
阳极 Cu-2e-═Cu2+
64g 2mol
6.4g 0.2mol
所以阳极质量减少6.4g;
阴极 Cu2++2e-═Cu
2mol 64g
0.2mol 6.4g
所以阴极质量增加6.4g;
所以两极质量相差 6.4g+6.4g═12.8g。以铜片作电极电解硫酸铜溶液,阳极溶解铜、阴极析出铜,硫酸铜溶液不变,所以电解液的pH不变。

 计算高手系列答案
计算高手系列答案【题目】工业上以CO为原料生产二甲醚的反应为:3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
实验 序号 | 容器 体积 | 起始物质的量 | 达平衡时 放出热量 | |
H2 | CO | |||
Ⅰ | 2L | 8mol | 8mol | 494 kJ |
Ⅱ | 2L | 4mol | 4mol | —— |

(1)上述反应平衡常数K的表达式为_____。
(2)由题意可知,a=______,b________1(填“>”、“<”或“=”)。
(3)实验Ⅰ中,反应前10 min内的平均速率v(H2)=_____。
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是______ (填写序号字母)。
a.及时分离出CH3OCH3气体b.保持容器的容积不变,再充入1 mol CO和1 mol H2
c.适当升高温度 d.保持容器的容积不变,充入1 mol 氦气
(5)T℃时,若容器中含1 molL-1 H2、2 molL-1 CO、2 molL-1 CH3OCH3、3 molL-1 CO2,则此时v正________v逆(填“>”、“<”或“=”)。
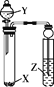
【题目】下列实验能达到相应实验目的的是
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D